Eilmeldung, aufregende Neuigkeiten! Am 20. November 2020 hat PRF einen wichtigen Teil unserer Mission erreicht: Lonafarnib, das erste Medikament gegen Progerie, hat die FDA-Zulassung erhalten.
Eilmeldung, aufregende Neuigkeiten! Am 20. November 2020 hat PRF einen wichtigen Teil unserer Mission erreicht: Lonafarnib, das erste Medikament gegen Progerie, hat die FDA-Zulassung erhalten.
Progeria tritt jetzt bei weniger als 5% der seltenen Krankheiten mit einer von der FDA zugelassenen Behandlung.* Kinder und junge Erwachsene mit Progerie können in den USA Lonafarnib jetzt auf Rezept und nicht mehr über eine klinische Studie erhalten.
Dieser bedeutende Meilenstein wurde dank 13 Jahren unermüdlicher Forschung erreicht, darunter vier klinische Studien, alles gemeinsam koordiniert von PRF, ermöglicht durch die mutigen Kinder und ihre Familien und finanziert von Ihnen, der wunderbaren Spendergemeinschaft von PRF.
Wir danken auch den erstklassigen Progerie-Forschungsteams am Boston Children's Hospital, Hasbro Children's Hospital, Brigham and Women's Hospital, Brown University, Boston University und den National Institutes of Health. Pharmazeutische Partner, die Lonafarnib kostenlos für PRF-unterstützte klinische Studien zur Verfügung stellten, waren ebenfalls von entscheidender Bedeutung, darunter Shering-Plough, Merck ** (außerhalb der USA und Kanadas als MSD bekannt) und Eiger BioPharmaceuticals, für ihren Beitrag, den Fortschritt in der Progerie-Forschung auf diese außergewöhnlichen neuen Höhen zu bringen.
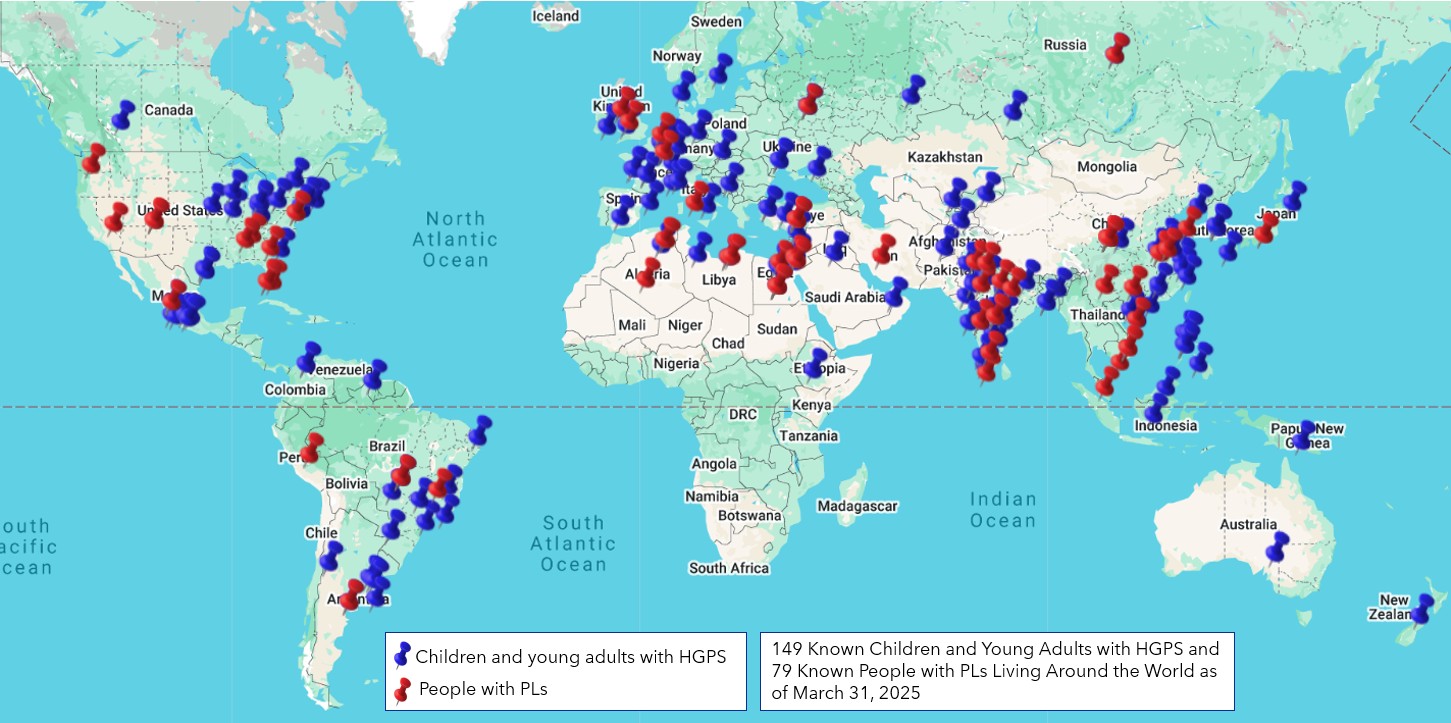
Unsere Partner bei Eiger setzen sich dafür ein, Patienten mit Progerie und verarbeitungsdefizienten progeroiden Laminopathien weltweit einen kontinuierlichen Zugang zu Lonafarnib zu ermöglichen, und sie haben Dienste eingerichtet, um den Zugang zu Lonafarnib zu unterstützen durch Eiger OneCare, sowie über Eigers Managed Access Program für Patienten außerhalb der USA. Die Prüfung von Lonafarnib durch die Europäische Arzneimittel-Agentur (EMA) ist noch im Gange; eine Entscheidung über die Zulassung durch die EMA wird für die zweite Hälfte des Jahres 2021 erwartet.
DANKE IHNEN ALLEN für die Unterstützung der Forschung, die uns zu diesem entscheidenden Punkt gebracht hat. Ihre anhaltende Unterstützung ermöglicht es uns auch, weiterhin nach einer Heilung für diese außergewöhnlichen Kinder zu suchen.
Was für ein wirklich bemerkenswerter Start in die Ferienzeit und ein Abschluss dieser unglaublich herausfordernd Jahr.
Klicken Sie hier für unsere Pressemitteilung das weitere Einzelheiten zu dieser historischen Neuigkeit liefert.
*300 seltene Krankheiten, für die es eine von der FDA zugelassene Behandlung gibt (https://www.rarediseases.info.nih.gov/diseases/FDS-orphan-drugs)/7,000 seltene Krankheiten, deren molekulare Grundlagen bekannt sind (www.OMIM.org) =4.2%
** PRF möchte den Wissenschaftlern von Schering-Plough / Merck R&D für ihre wichtigen Beiträge danken, die sowohl die Evaluierung von Lonafarnib in präklinischen HGPS-Modellen als auch die klinischen Studien an Progerie-Patienten. Das Team unter der Leitung von W. Robert Bishop, John Piwinski, Cecil Pickett und Catherine Strader unterstützte pharmakokinetische/pharmakodynamische Studien, optimierte die Arzneimittelformulierung und sorgte für eine ausreichende Arzneimittelversorgung während dieser Studien. Zu den Mitgliedern dieses Teams gehörten: Susan Arbuck, Art Bertelsen, Alan Cooper, Emily Frank, David Harris, Georgianna Harris, Paul Kirschmeier, Ming Liu, Jin-Keon Pai, Robert Patton, Paul Statkevich, Greg Szpunar, Bohdan Yaremko, Paul Zavodny und Yali Zhu.