Quoi de neuf dans
Recherche sur la progéria
Nous avons ajouté cette section afin que vous puissiez accéder facilement aux informations sur les publications scientifiques les plus récentes et les plus importantes sur la recherche sur la progéria.
En plus des articles mis en évidence ci-dessous, il existe désormais des centaines d'articles sur la progéria et les sujets liés à la progéria. Nous vous suggérons de rechercher dans PubMed le(s) sujet(s) spécifique(s) que vous recherchez.
Mars 2023 : Des étapes de recherche passionnantes dans l’évaluation des traitements et la prolongation de la vie !
Nous sommes ravis de partager avec vous deux mises à jour de recherche passionnantes, publiées en ligne aujourd'hui dans la plus grande revue cardiovasculaire au monde, Diffusion (1):
Biomarqueur dans la progéria
Une nouvelle méthode de mesure de la progérine, la protéine toxique responsable de la progéria, a été mise au point par une équipe dirigée par le Dr Leslie Gordon, cofondateur et directeur médical de la PRF. Grâce à la découverte de ce biomarqueur, qui utilise le plasma sanguin pour mesurer les niveaux de progérine, les chercheurs peuvent comprendre comment les traitements affectent les participants aux essais cliniques après une période de temps plus courte et à plusieurs moments de chaque essai clinique.
Ce test peut optimiser le processus d’essai clinique en fournir des informations précoces sur l'efficacité des traitements testés, en guise d'introduction à d'autres tests cliniques tels que la prise de poids, les changements dermatologiques, la contracture et la fonction articulaires, etc., qui nécessitent tous beaucoup plus de temps pour se manifester. Ces caractéristiques cliniques de la progéria sont des mesures importantes à long terme des effets du traitement qui sont désormais complétées par les niveaux de progérine mesurés plus tôt dans le traitement. Nous pouvons désormais être en mesure de comprendre les bénéfices du traitement dès quatre mois après le début du traitement, ou d'arrêter un traitement qui pourrait ne pas bénéficier au participant à l'essai, afin d'éviter des effets secondaires inutiles.
Une vie encore plus longue grâce au lonafarnib
En plus d'accélérer les futures découvertes de traitements et de remèdes, cette nouvelle méthode innovante de mesure de la progérine indique que la Les bénéfices à long terme du lonafarnib pour les enfants atteints de progéria sont supérieurs à ceux précédemment déterminés.
Les données de l'étude indiquent que des taux de progérine plus faibles dans le sang reflètent un avantage en termes de survie : plus une personne atteinte de progéria reste longtemps sous lonafarnib, plus le bénéfice de survie du traitement est important. Les taux de progérine ont diminué d'environ 30 à 60% pendant toute la durée du traitement, et l'espérance de vie des patients sous traitement pendant plus de 10 ans a été estimée augmenter de près de 5 ans. plus d'une augmentation de 35% de la durée de vie moyenne, de 14,5 ans à près de 20 ans!
Pour en savoir plus, consultez notre communiqué de presse ici
« L’une des histoires les plus remarquables jamais partagées dans ce podcast »
– Dr Carolyn Lam, cardiologue de renommée mondiale et animatrice du podcast La circulation en marche, sur le voyage qui a conduit à ces découvertes passionnantes. Écoutez l'interview complète sur l'impact profond de cette étude directement du Dr Gordon. Écouter ici ((à partir de 6:41).
Écoutez le Dr Leslie Gordon sur le podcast Circulation on the Run
Et en juin, deux articles éditoriaux (2) et (3) ont été publiés dans Circulation soulignant l’importance cruciale de ce biomarqueur pour faire progresser les traitements et la guérison des enfants atteints de progéria et pour une meilleure compréhension du vieillissement.

(1) Gordon, LB, Norris, W., Hamren, S., et al. Progérine plasmatique chez les patients atteints du syndrome de Hutchinson-Gilford Progeria : développement d'immuno-essais et évaluation clinique. Circulation, 2023
(2) Progression des anomalies cardiaques dans le syndrome de Hutchinson-Gilford Progeria : une étude longitudinale prospective.
Olsen FJ, Gordon LB, Smoot L, Kleinman ME, Gerhard-Herman M, Hegde SM, Mukundan S, Mahoney T, Massaro J, Ha S, Prakash A. Circulation. 6 juin 2023 ;147(23):1782-1784. doi : 10.1161/CIRCULATIONAHA.123.064370. Publication en ligne le 5 juin 2023.
(3) Outils facilement disponibles pour détecter la progérine et la progression des maladies cardiaques dans le syndrome de Hutchinson-Gilford Progeria.
Eriksson M, Haugaa K, Revêchon G. Circulation. 6 juin 2023 ;147(23):1745-1747. doi : 10.1161/CIRCULATIONAHA.123.064765. Publication en ligne le 5 juin 2023.
Mars 2021 : Des avancées passionnantes dans le domaine des thérapies à base d’ARN pour la progéria !
Nous sommes ravis de partager les résultats de deux études révolutionnaires très intéressantes sur l'utilisation des thérapies à base d'ARN dans la recherche sur la progéria. Les deux études ont été cofinancées par la Progeria Research Foundation (PRF) et coécrites par le directeur médical de la PRF, le Dr Leslie Gordon.
La progérine est la protéine responsable de la maladie de la progéria. Les thérapies à base d'ARN interfèrent avec la capacité du corps à produire de la progérine, en bloquant sa production au niveau de l'ARN. Cela signifie que le traitement est plus spécifique que la plupart des thérapies qui ciblent la progérine au niveau protéique.
Bien que chaque étude ait utilisé un système d'administration de médicament différent, les deux études visaient la même stratégie de traitement de base, à savoir inhiber la production d'ARN codant pour la protéine anormale, la progérine. Les deux études ont été menées par des chercheurs des National Institutes of Health (NIH) et ont été publiées aujourd'hui dans la revue Médecine naturelle.
Une étude, dirigé par Francis Collins, MD, PhD, directeur du NIH, a montré que le traitement des souris atteintes de Progeria avec un médicament appelé SRP2001 ra réduit l'expression nocive de l'ARNm et de la protéine progérine dans l'aorte, l'artère principale du corps, ainsi que dans d'autres tissus. À la fin de l'étude, la paroi aortique est restée plus solide et les souris ont démontré une augmentation de la survie de plus de 60%.
« Le fait qu’une thérapie ciblée à base d’ARN montre des résultats aussi significatifs dans un modèle animal me donne l’espoir que cela pourrait conduire à une avancée majeure dans le traitement de la progéria », a déclaré Collins.
Le autre étude, dirigé par Tom Misteli, PhD, directeur du Centre de recherche sur le cancer, National Cancer Institute, NIH, a montré une 90 – 95% réduction de l'ARN toxique producteur de progérine dans différents tissus après traitement avec un médicament appelé LB143. Le laboratoire de Misteli a découvert que la réduction de la protéine progérine était plus efficace dans le foie, avec des améliorations supplémentaires dans le cœur et l'aorte.
Nous savons maintenant qu'il existe plusieurs façons de réduire la production de la protéine progérine nocive à l'aide de thérapies à base d'ARN. Chaque étude a trouvé différentes séquences d'ARN dans les modèles de souris qui, lorsqu'elles étaient ciblées, offraient une voie efficace pour le traitement, ce qui a permis d'obtenir Souris atteintes de Progeria qui ont vécu beaucoup plus longtemps que celles traitées dans des études précédentes avec Zokinvy (lonafarnib), le seul médicament approuvé par la FDA pour les enfants atteints de progéria. De plus, les chercheurs ont découvert qu'un traitement combiné avec des thérapies à base d'ARN et Zokinvy (lonafarnib) réduisait les niveaux de protéines progérines dans le foie et le cœur plus efficacement que chaque traitement pris seul.
« Ces deux études très importantes démontrent la des avancées majeures qui sont désormais à nos portes « Nous sommes ravis de travailler avec ces brillants groupes de recherche pour faire progresser la thérapie à ARN pour les enfants atteints de progéria », a déclaré le Dr Leslie Gordon, directrice médicale du PRF. « Il s’agit de deux études de démonstration de principe passionnantes, et PRF est ravi de progresser vers les essais cliniques qui appliquent ces stratégies de traitement.
—
Erdos, MR, Cabral, WA, Tavarez, UL et al. Une approche thérapeutique antisens ciblée pour le syndrome de progéria de Hutchinson-Gilford. Médecine Nat (2021). https://doi.org/10.1038/s41591-021-01274-0
Puttaraju, M., Jackson, M., Klein, S. et al. Le dépistage systématique identifie les oligonucléotides antisens thérapeutiques pour le syndrome de progéria de Hutchinson-Gilford. Médecine Nat (2021). https://doi.org/10.1038/s41591-021-01262-4
Janvier 2021 : Progrès remarquables en matière d'édition génétique dans les modèles murins atteints de Progeria
La revue scientifique Nature résultats révolutionnaires publiés démontrant que l’édition génétique dans un modèle murin de Progeria corrigeait la mutation qui cause la Progeria dans de nombreuses cellules, améliorait plusieurs symptômes clés de la maladie et augmentait considérablement la durée de vie des souris.
Cofinancée par la PRF et coécrite par le Dr Leslie Gordon, directrice médicale de la PRF, l'étude a révélé qu'avec une seule injection d'un éditeur de base programmé pour corriger la mutation à l'origine de la maladie, les souris ont survécu 2,5 fois plus longtemps que les souris Progeria témoins non traitées, jusqu'à un âge correspondant au début de la vieillesse chez les souris en bonne santé. Fait important, les souris traitées ont également conservé un tissu vasculaire sain, une découverte significative, car la perte d'intégrité vasculaire est un prédicteur de mortalité chez les enfants atteints de Progeria.
L'étude a été codirigée par l'expert mondial en édition génétique, David Liu, PhD, du Broad Institute, MIT, Jonathan Brown, professeur adjoint de médecine à la division de médecine cardiovasculaire de l'université Vanderbilt, et Francis Collins, MD, PhD, directeur des National Institutes of Health.
« Observer cette réponse spectaculaire dans notre modèle de souris Progeria est l’un des développements thérapeutiques les plus passionnants auxquels j’ai participé en 40 ans en tant que médecin-chercheur », a déclaré le Dr Collins.
« Il y a cinq ans, nous étions encore en train de terminer le développement du tout premier éditeur de base », a déclaré le Dr Liu. « Si vous m'aviez dit à l'époque qu'en cinq ans, une seule dose d'un éditeur de base pourrait traiter la progéria chez un animal au niveau de l'ADN, de l'ARN, des protéines, de la pathologie vasculaire et de la durée de vie, j'aurais répondu "c'est impossible". C'est un véritable témoignage du dévouement de l'équipe qui a rendu ce travail possible. »
Des études précliniques supplémentaires sont nécessaires pour étudier ces résultats, qui, nous l'espérons, donneront un jour lieu à un essai clinique. Pour en savoir plus sur cette nouvelle passionnante, lisez ce Wall Street Journal article.
Novembre 2020 : Approbation par la FDA du lonafarnib (Zokinvy)
Le 20 novembre 2020, PRF a accompli une partie importante de sa mission : le lonafarnib, le tout premier traitement contre la progéria, a reçu l'approbation de la FDA.
La progéria rejoint désormais moins de 5% des maladies rares avec un traitement approuvé par la FDA.* Les enfants et les jeunes adultes atteints de progéria aux États-Unis peuvent désormais accéder au lonafarnib (désormais appelé « Zokinvy ») sur ordonnance, au lieu d'un essai clinique.
Cette étape importante a été franchie grâce à 13 années de recherche acharnée impliquant quatre essais cliniques, tous coordonnés par le PRF, rendus possibles par les enfants courageux et leurs familles, et financés par vous, la merveilleuse communauté de donateurs du PRF.
Cliquez ici pour plus d'informations.
*300 maladies rares pour lesquelles un traitement a été approuvé par la FDA (https://www.rarediseases.info.nih.gov/diseases/FDS-orphan-drugs)/7 000 maladies rares pour lesquelles la base moléculaire est connue (www.OMIM.org) = 4,2%
Avril 2018 : Une étude mondiale publiée dans le JAMA révèle que le traitement au lonafarnib prolonge la survie des enfants atteints de progéria
Cliquez ici pour plus de détails.
Association entre le traitement par lonafarnib et l'absence de traitement et le taux de mortalité chez les patients atteints du syndrome de Hutchinson-Gilford-Progeria, Leslie B. Gordon, MD, PhD; Heather Shappell, PhD; Joe Massaro, PhD; Ralph B. D'Agostino Sr., PhD; Joan Brazier, MS; Susan E. Campbell, MA; Monica E. Kleinman, MD; Mark W. Kieran, MD, PhD; JAMA, 24 avril 2018.
Juillet 2016 : Résultats du Triple Procès
Octobre 2014 : Le parcours remarquable du PRF publié dans Expert Opinion
 Dans un article publié dans Avis d'expert et rédigé par la directrice exécutive Audrey Gordon et la directrice médicale Leslie Gordon, les deux dirigeants du PRF discutent de l'histoire, des objectifs et des réalisations du PRF, et de la manière dont les programmes du PRF ont été essentiels dans le voyage de l'obscurité au traitement.
Dans un article publié dans Avis d'expert et rédigé par la directrice exécutive Audrey Gordon et la directrice médicale Leslie Gordon, les deux dirigeants du PRF discutent de l'histoire, des objectifs et des réalisations du PRF, et de la manière dont les programmes du PRF ont été essentiels dans le voyage de l'obscurité au traitement.
Les auteurs écrivent : « Nous espérons que la description des programmes et services de la PRF qui suit, ainsi qu’un compte rendu de la manière dont ils aident la PRF à accomplir sa mission de sauver les enfants atteints de progéria, aideront et inspireront d’autres personnes à prendre des mesures similaires pour les nombreuses populations atteintes de maladies rares qui ont besoin d’une attention immédiate. »
Mai 2014 : Une étude révèle que les médicaments expérimentaux augmentent l'espérance de vie des enfants atteints de progéria
Cette étude démontre qu'il existe des preuves qu'un inhibiteur de la farnésyltransférase (FTI) peut prolonger la vie des enfants atteints de progéria d'au moins un an et demi. L'étude a montré une prolongation de la survie moyenne de 1,6 an au cours des six années suivant le début du traitement. Deux autres médicaments ajoutés plus tard dans les essais, la pravastatine et le zolédronate, pourraient également contribuer à cette découverte. Il s’agit de la première preuve que les traitements influencent la survie pour cette maladie mortelle.
Cliquez ici pour plus de détails.
Impact des inhibiteurs de la farnésylation sur la survie dans le syndrome de Hutchinson-Gilford progéria, Leslie B. Gordon, MD, PhD, Joe Massaro, PhD, Ralph B. D'Agostino Sr., PhD, Susan E. Campbell, MA, Joan Brazier, MS, W. Ted Brown, MD, PhD, Monica E Kleinman, MD, Mark W. Kieran MD, PhD et le Progeria Clinical Trials Collaborative; Circulation, 2 mai 2014 (en ligne).
Septembre 2012 : Découverte du tout premier traitement contre la progéria
Les résultats de le tout premier essai clinique de médicament destiné aux enfants Les résultats de l'étude* sur la progéria révèlent que le lonafarnib, un type d'inhibiteur de la farnésyltransférase (FTI) développé à l'origine pour traiter le cancer, s'est avéré efficace contre la progéria. Chaque enfant a montré une amélioration dans un ou plusieurs des quatre domaines suivants : prise de poids supplémentaire, meilleure audition, amélioration de la structure osseuse et/ou, plus important encore, augmentation de la flexibilité des vaisseaux sanguins. L'étude* a été financée et coordonnée par la Progeria Research Foundation.
Cliquez ici pour plus de détails.
*Gordon LB, Kleinman ME, Miller DT, Neuberg D, Giobbie-Hurder A, Gerhard-Herman M, Smoot L, Gordon CM, Cleveland R, Snyder BD, Fligor B, Bishop WR, Statkevich P, Regen A, Sonis A, Riley S, Ploski C, Correia A, Quinn N, Ullrich NJ, Nazarian A, Liang MG, Huh SY, Schwartzman A, Kieran MW, Essai clinique d'un inhibiteur de la farnésyltransférase chez les enfants atteints du syndrome de Hutchinson-Gilford-Progeria, Actes de l'Académie nationale des sciences, 9 octobre 2012 vol. 109 no. 41 16666-16671
Octobre 2011 : Une nouvelle approche de la thérapie de la progéria
En 2005, il a été démontré que l'épissage anormal des cellules cutanées cultivées de Progeria pouvait être évité de cette manière (2). Cependant, pour traiter les patients, le réactif inhibiteur doit être délivré intact à tous les tissus du patient. Il a fallu six années supplémentaires et des travaux dans plusieurs laboratoires pour développer ces méthodes de « délivrance ».
Dans la nouvelle étude (1), le blocage de l'épissage anormal chez la souris modèle a donné des résultats impressionnants. On a observé une nette réduction des concentrations de progérine dans tous les tissus analysés, à l'exception du muscle squelettique, qui peut avoir une absorption réduite de l'agent bloquant. Les souris modèles ont récapitulé de nombreux phénotypes des patients atteints de progéria, notamment
- Durée de vie considérablement réduite (103 jours contre 2 ans pour les souris de type sauvage).
- Réduction du taux de croissance.
- Posture anormale avec courbure de la colonne vertébrale.
- Aberrations nucléaires profondes résultant de l'accumulation de progérine.
- Perte générale de la couche de graisse sous la peau.
- Altérations osseuses profondes.
- Altérations cardiovasculaires, y compris une perte importante de cellules musculaires lisses vasculaires.
- Modifications des concentrations de diverses hormones dans le plasma sanguin circulant, notamment l’insuline et l’hormone de croissance.
Le in vivo La démonstration de l’efficacité de la réduction de la production de progérine en bloquant l’épissage aberrant est un candidat solide pour une nouvelle approche précieuse de la thérapie de la Progéria.
(1) Osorio FG, Navarro CL, Cadiñanos J, López-Mejia IC, Quirós PM, et al, Science Translational Medicine, 3: Numéro 106, publication anticipée en ligne, 26 octobre (2011).
(2) Scaffidi, P. et Misteli, T. Inversion du phénotype cellulaire dans le syndrome de Hutchinson-Gilford, une maladie de vieillissement prématuré, Nature Medicine 11 (4): 440-445 (2005).
Juin 2011 : Une étude financée par le PRF identifie la rapamycine comme traitement possible pour la progéria
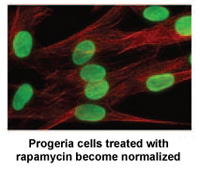
Des chercheurs des National Institutes of Health et du Massachusetts General Hospital de Boston, dans le Massachusetts, ont publié aujourd'hui une nouvelle étude Sciences, Médecine translationnelle Cela pourrait conduire à un nouveau traitement médicamenteux pour les enfants atteints de progéria.*
Rapamycin La rapamycine est un médicament approuvé par la FDA qui a déjà montré qu'il prolongeait la vie des modèles de souris non atteintes de progéria. Cette nouvelle étude démontre que la rapamycine diminue la quantité de la protéine progérine responsable de la maladie de 50%, améliore la forme nucléaire anormale et prolonge la durée de vie des cellules progéria. Cette étude fournit la première preuve que la rapamycine pourrait être capable de réduire les effets néfastes de la progérine chez les enfants atteints de progéria.
La couverture médiatique est énorme à ce sujet ! Cliquez ci-dessous pour accéder aux liens vers les articles des médias :
Blog sur la santé du Wall Street Journal
Actualités américaines et mondiales
La Fondation de recherche sur la progéria a été ravie de fournir des cellules pour ce projet à partir de la Banque de cellules et de tissus PRF, et aidez à financer la recherche grâce à notre programme de subventions.
Cette nouvelle étude passionnante démontre le rythme remarquable de la recherche sur la progéria, tout en offrant un meilleur aperçu du processus de vieillissement qui nous affecte tous.
*« La rapamycine inverse les phénotypes cellulaires et améliore la clairance des protéines mutantes dans les cellules progéria de Hutchinson-Gilford »
Kan Cao, John J. Graziotto, Cecilia D. Blair, Joseph R. Mazzulli, Michael R. Erdos, Dimitri Krainc, Francis S. Collins
Sci Transl Med. 2011 29 juin;3(89):89ra58.
Juin 2011 : étude révolutionnaire sur le lien entre la progéria et le vieillissement
Journal du soir de CBS, Wall Street Journal et Autres Rapport sur une nouvelle étude
Des chercheurs des National Institutes of Health ont découvert un lien jusqu'alors inconnu entre la progéria et le vieillissement. Les résultats apportent des informations sur la relation entre la protéine toxique à l'origine de la progéria, connue sous le nom de progérine et télomères, qui protègent les extrémités de l’ADN dans les cellules jusqu’à ce qu’elles s’usent avec le temps et que les cellules meurent.
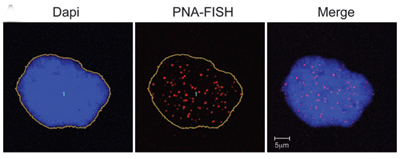
Les cellules exprimant la progérine provenant d'individus normaux présentent des signes de sénescence. L'ADN du noyau est coloré en bleu. Les télomères sont visibles sous forme de points rouges.
L'étude* est parue dans l'édition en ligne du 13 juin 2011 du Journal of Clinical Investigation. Elle conclut que dans le vieillissement normal, les télomères courts ou dysfonctionnels stimulent les cellules à produire de la progérine, qui est associée aux dommages cellulaires liés à l'âge.
«« Pour la première fois, nous savons que le raccourcissement et le dysfonctionnement des télomères influencent la production de progérine », explique le Dr Leslie B. Gordon, directrice médicale de la Progeria Research Foundation. « Ces deux processus, qui influencent tous deux le vieillissement cellulaire, sont donc en réalité liés. »
Des recherches antérieures ont montré que la progérine n’est pas seulement produite chez les enfants atteints de progéria, mais qu’elle est produite en plus petite quantité chez nous tous, et que les niveaux de progérine augmentent avec l’âge. Indépendamment, des recherches antérieures sur le raccourcissement et le dysfonctionnement des télomères ont été associées au vieillissement normal. Depuis 2003, avec la découverte de la mutation du gène de la progéria et de la protéine progérine qui cause la maladie, l’un des principaux domaines de recherche s’est concentré sur la compréhension du lien entre la progéria et le vieillissement.
« L’association entre ce phénomène de maladie rare et le vieillissement normal porte ses fruits de manière importante », a déclaré le directeur du NIH, Francis S. Collins, docteur en médecine et auteur principal de l’étude. « Cette étude montre que l’étude de troubles génétiques rares tels que la progéria permet d’obtenir des informations biologiques précieuses. Nous avons senti dès le départ que la progéria avait beaucoup à nous apprendre sur le processus normal de vieillissement. »
Les scientifiques ont traditionnellement étudié les télomères et la progérine séparément. Bien qu’il reste encore beaucoup à apprendre pour savoir si cette nouvelle connexion peut conduire à un traitement pour les enfants atteints de progéria ou peut potentiellement être appliquée à l’allongement de la durée de vie humaine, cette étude fournit une preuve supplémentaire que la progérine, la protéine toxique découverte grâce à la découverte de la mutation génétique de la progéria, joue un rôle dans le processus normal de vieillissement.
*La progérine et le dysfonctionnement des télomères collaborent pour déclencher la sénescence cellulaire dans les fibroblastes humains normaux, Cao et al, J Clin Invest doi:10.1172/JCI43578.
Cliquez ici pour le texte intégral du communiqué de presse du NIH.
Mai 2011 : découverte de la cause du syndrome progéroïde, apportant un éclairage supplémentaire sur le lien entre la progéria et le vieillissement
Une équipe de recherche dirigée par un chercheur sur la progéria Dr Carlos López-Otín Une équipe de chercheurs de l’Université d’Oviedo en Espagne a rencontré deux familles dont les enfants étaient atteints d’une maladie du vieillissement accéléré jusqu’alors inconnue, semblable à la progéria. Les enfants ne présentaient aucun défaut dans les gènes qui avaient été précédemment liés aux maladies progéroïdes, mais en étudiant les parties « codantes » de leurs génomes, l’équipe a découvert un défaut dans un gène appelé BANF1. Les membres de la famille atteints de la maladie progéroïde présentaient de très faibles quantités de la protéine produite par BANF1 et, comme les personnes atteintes de progéria, les enveloppes nucléaires de leurs cellules étaient nettement anormales. Les anomalies ont disparu lors d’expériences de culture cellulaire lorsque le gène défectueux a été remplacé par la version correcte. Les résultats ont été publiés dans la revue Journal américain de génétique humaine en mai 2011.
BANF1 rejoint désormais le groupe de gènes connus qui semblent influencer certaines formes de vieillissement prématuré – et qui pourraient également affecter le vieillissement normal.
Ces dernières années, les scientifiques ont pu mieux comprendre le vieillissement normal au niveau moléculaire, en partie grâce à des études sur des syndromes de vieillissement prématuré comme celui-ci, ainsi que sur la progéria, qui « provoque le développement précoce de caractéristiques normalement associées à un âge avancé », a déclaré López-Otín. Il a ajouté que son étude « souligne l’importance de la lame nucléaire pour le vieillissement humain et démontre l’utilité des nouvelles méthodes de séquençage du génome pour identifier la cause génétique de maladies rares et dévastatrices, qui ont traditionnellement reçu une attention limitée ».
Xose S. Puente, Victor Quesada, Fernando G. Osorio, Rubén Cabanillas, Juan Cadiñanos, Julia M. Fraile, Gonzalo R. Ordóñez, Diana A. Puente, Ana Gutiérrez-Fernández, Miriam Fanjul-Fernández et al. "Le séquençage de l'exome et l'analyse fonctionnelle identifient la mutation BANF1 comme la cause d'un syndrome progéroïde héréditaire." Revue américaine de génétique humaine, 5 mai 2011 DOI : 10.1016/j.ajhg.2011.04.010
Août 2010 : Le facteur de croissance analogue à l'insuline de type 1 améliore les symptômes et prolonge la vie d'une souris progéroïde
Le 26 août 2010, Artériosclérose, thrombose et biologie vasculaire Les résultats d’une étude comparant la progéria et le vieillissement cardiovasculaire typique, intitulée « Pathologie cardiovasculaire dans la progéria de Hutchinson-Gilford : corrélation avec la pathologie vasculaire du vieillissement », ont été publiés électroniquement avant impression. L’étude a révélé que la progérine, la protéine anormale responsable de la progéria, est également présente dans le système vasculaire de la population générale et augmente avec l’âge, ce qui renforce les arguments de plus en plus nombreux en faveur d’un parallèle entre le vieillissement normal et le vieillissement dû à la progéria.
Les chercheurs ont examiné les autopsies cardiovasculaires et la distribution de la progérine chez des patients atteints de Progeria ainsi qu'un groupe sans Progeria entre les âges d'un mois et 97 ans, et ont découvert que la progérine chez les individus sans Progeria augmentait en moyenne de 3,3 pour cent par an dans les artères coronaires.
« Nous avons découvert des similitudes entre de nombreux aspects des maladies cardiovasculaires, à la fois dans la progéria et dans l’athérosclérose qui touche des millions de personnes dans le monde », a déclaré le Dr Leslie Gordon, auteur principal de l’étude et directeur médical de la Progeria Research Foundation. « En examinant l’une des maladies les plus rares au monde, nous acquérons des connaissances cruciales sur une maladie qui touche des millions de personnes dans le monde. Les recherches en cours ont le potentiel d’avoir un impact significatif sur notre compréhension des maladies cardiaques et du vieillissement. »
Cette étude soutient la possibilité que la progérine contribue au risque d’athérosclérose dans la population générale et mérite d’être examinée en tant que nouveau trait potentiel pour aider à prédire le risque de maladie cardiaque.
Français Olive M, Harten I, Mitchell R, Beers J, Djabali K, Cao K, Erdos MR, Blair C, Funke B, Smoot L, Gerhard-Herman M, Machan JT, Kutys R, Virmani R, Collins FS, Wight TN, Nabel EG, Gordon LB.
« Pathologie cardiovasculaire dans la progéria de Hutchinson-Gilford : corrélation avec la pathologie vasculaire du vieillissement ». Artérioscléreux Thromb Vasc Biol. 2010 novembre ; 30 (11) : 2301-9 ; Publication en ligne le 26 août 2010.
Mai 2010 : Des études menées à Oxford montrent comment la recherche sur la progéria peut améliorer notre compréhension du vieillissement normal
Cette situation est très similaire à celle de la Progéria. Dans ce cas, la prélamine A (appelée progérine) conserve le groupe farnésyle. En effet, l'étape initiale de la maladie est l'échec de l'élimination du groupe farnésyle. Cet échec se produit parce que la mutation de la Progéria entraîne la suppression de la partie de la prélamine A nécessaire à la liaison de FACE 1 et à l'élimination du groupe farnésyle. Ainsi, la cause des défauts du vieillissement et de la Progéria est la même : FACE1 ne peut pas faire son travail.
On sait depuis quelques années que les inhibiteurs de la farnésyltransférase (FTI) inhibent (et peuvent inverser) la présence de marqueurs nucléaires de la maladie dans les cellules de Progeria. Shanahan et al ont maintenant découvert que les FTI inhibent l’apparition de marqueurs nucléaires similaires dans les cellules d’individus normaux âgés. Les FTI sont actuellement utilisés dans les essais cliniques sur la Progeria et Shanahan et al notent que ces essais cliniques « apporteront un éclairage supplémentaire sur le potentiel thérapeutique de ces médicaments dans le traitement du vieillissement ».
Les études décrites dans cet article sont le meilleur exemple à ce jour de la manière dont les études sur la progéria améliorent notre compréhension du vieillissement normal.
Ragnauth CD, Warren DT, Liu Y, Shanahan CM et al, « La prélamine A agit pour accélérer la sénescence des cellules musculaires lisses et constitue un nouveau biomarqueur du vieillissement vasculaire humain. » Circulation : 25 mai 2010, pp. 2200-2210.
Avril 2010 : Nouvelle preuve que dans la Progeria, la présence d'un groupe farnésyle dans la molécule de progérine est responsable des symptômes de la maladie.
Davies et ses collègues ont préparé un nouveau modèle de souris dont la prélamine A, contrairement à la prélamine A RD, n'est pas farnésylée, mais conserve la séquence de 15 acides aminés qui est normalement clivée dans le chemin de synthèse de la lamine A. Cette souris ne présente pas de symptômes progéroïdes, ce qui indique que dans le RD, ainsi que dans la Progeria, la présence du groupe farnésyle, et non un changement de séquence d'acides aminés, est responsable des symptômes de la maladie.
Davies BS, Barnes RH 2nd, Tu Y, Ren S, Andres DA, Spielmann HP, Lammerding J, Wang Y, Young SG, Fong LG,
« Une accumulation de prélamine A non farnésylée provoque une cardiomyopathie mais pas de progéria », Hum Mol Genet. 26 avril 2010. [Publication électronique avant impression]
Février 2010 : De nouvelles preuves démontrent que les FTI ont des effets bénéfiques grâce à la farnésylation de la progérine
Les auteurs ont évalué la possibilité que l'amélioration de la maladie progéroïde par un inhibiteur de la farnésyltransférase (FTI) dans un modèle murin de Progeria soit due à l'effet du médicament sur la farnésylation de protéines autres que la progérine. Ils ont construit une souris qui produisait de la progérine non farnésylée, mais pas de la progérine farnésylée. Cette souris a également développé des phénotypes de maladie de type progéroïde, mais le FTI ne les a pas améliorés. Ce résultat indique que le médicament n'agit pas en inhibant des protéines autres que la progérine ; il doit agir sur la farnésylation de la progérine, l'étape biochimique qui n'est pas présente dans le modèle testé.
Yang SH, Chang SY, Andres DA, Spielmann HP, Young SG, Fong LG. « Évaluation de l’efficacité des inhibiteurs de la protéine farnésyltransférase dans des modèles murins de progéria. »
J Lipid Res. 2010 févr.;51(2):400-5. Epub 2009 oct. 26.
Octobre 2009 : Les arts rencontrent les sciences dans l'histoire de Benjamin Button
Maloney WJ, « Le syndrome de Hutchinson-Gilford Progeria : sa présentation dans la nouvelle de F. Scott Fitzgerald « L'étrange cas de Benjamin Button » et ses manifestations orales. »
J. Dent. Res 2009 octobre 88 (10) : 873-6
Mai 2009 : Un article ouvre de nouvelles perspectives sur l’effet du HGPS sur les fonctions cellulaires.
Il a déjà été démontré que le HGPS affecte de nombreuses fonctions cellulaires fondamentales, notamment la réplication, l’expression génétique et la réparation de l’ADN. Busch et ses collègues ont ajouté à cette liste le transport des protéines du cytoplasme vers le noyau. Toutes les protéines sont synthétisées dans le cytoplasme, et celles qui finissent par se retrouver dans le noyau doivent traverser la membrane nucléaire. Le transport s’effectue par des canaux dans la membrane nucléaire appelés « pores nucléaires ». De nombreuses protéines sont trop grosses pour simplement se diffuser à travers les pores nucléaires, mais sont « introduites » à travers eux par des protéines spéciales qui ont évolué à cette fin. Dans cet article, il a été constaté que les cellules qui expriment le gène mutant responsable du HGPS présentaient un transport réduit de protéines dans les noyaux par mesure directe.
Busch A, Kiel T, Heupel WM, Wehnert M, Huebner S., « L’importation de protéines nucléaires est réduite dans les cellules exprimant des mutants de lamine A responsables d’une enveloppopathie nucléaire. » Exp Cell Res. 11 mai 2009.
Avril 2009 : Lien entre la progéria et le vieillissement normal : nouvelles perspectives
→ Fournir structure et organisation : architecture nucléaire et intégrité du génome
→ Les dommages et la réparation de l'ADN ont mal tourné
→ Les suppresseurs de tumeurs anciens et au-delà de la réparation et de la sénescence cellulaire, et
→ Régénération et renouvellement : la biologie des cellules souches. Régénération et renouvellement : la biologie des cellules souches.
L’article met en évidence la manière dont les avancées récentes dans l’étude des maladies progéroïdes donnent un aperçu des fonctions cellulaires de base ainsi que du vieillissement.
Capell BS, Tlougan BE, Orlow SJ, « Du plus rare au plus courant : aperçu des syndromes progéroïdes sur le cancer de la peau et le vieillissement. » Journal de dermatologie d'investigation (23 avril 2009), 1-11
Avril 2009 : D'anciens bénéficiaires de subventions de recherche du PRF élaborent une nouvelle méthode pour étudier la progérine dans les cellules
Des expériences antérieures sur des cellules fibroblastes de patients atteints de Progeria ont montré que les dommages causés par la mutation sont initialement le résultat de l'action de la forme altérée de la Lamine A, appelée Progérine. Mais l'interprétation de ces expériences peut être difficile en culture sur un nombre variable de générations. Fong et al. ont mis au point un système expérimental dans lequel la quantité de Progérine dans Type sauvage Les cellules progérines peuvent être augmentées ou diminuées. Cette méthode permettra aux chercheurs de distinguer les effets directs de la progérine des effets secondaires, faisant ainsi progresser l'étude des mécanismes cellulaires qui conduisent à la physiopathologie des cellules progérines.
Activation de la synthèse de la progérine, la prélamine A mutante dans le syndrome de progéria de Hutchinson-Gilford, avec des oligonucléotides antisens. (Article PubMed) Fong LG, Vickers TA, Farber EA, Choi C, Yun UJ, Hu Y, Yang SH, Coffinier C, Lee R, Yin L, Davies BS, Andres DA, Spielmann HP, Bennett CF, Young SG, « Activation de la synthèse de la progérine, la prélamine A mutante dans le syndrome de progéria de Hutchinson-Gilford, avec des oligonucléotides antisens. » Hum Mol Genet. 17 avril 2009.
Les Drs Fong et Young ont déjà été financés par des subventions de la Progeria Research Foundation.
Janvier 2009 : Quantification de l'expression du gène Progeria dans les cellules normales et Progeria par une nouvelle technique puissante.
Une équipe suédoise découvre une accumulation d'ARN progérine dans les cellules normales à mesure qu'elles vieillissent
La progérine est la protéine anormale responsable de la progéria. Au cours des dernières années, plusieurs groupes de recherche ont découvert que les cellules normales produisent également de la progérine, mais beaucoup moins que les cellules d'un enfant atteint de progéria. De plus, la quantité de protéine progérine dans les cellules normales augmente avec l'âge en laboratoire. Ces résultats ont établi un lien direct au niveau cellulaire entre la progéria et le vieillissement normal.
Le Dr Maria Eriksson, auteur de la découverte du gène de la progéria en 2003, a inventé une nouvelle technique puissante pour mesurer quantitativement l'expression du gène de la progéria. Le laboratoire du Dr Eriksson à l'Institut Karolinska en Suède a utilisé cette technique pour mesurer la quantité d'ARN progérine dans les cellules normales et les cellules progéria. L'ARN est la molécule de référence de nos cellules pour la fabrication des protéines. Le groupe suédois a découvert que les cellules normales et les cellules progéria produisent des quantités de plus en plus importantes d'ARN progérine à mesure qu'elles vieillissent. Les résultats d'Eriksson montrent que le signal ARN pour la production de progérine se développe rapidement dans les cellules des enfants atteints de progéria et se développe lentement au cours de la vie chez nous tous.
Ces nouvelles découvertes renforcent notre compréhension du lien entre le vieillissement normal et la progéria. De plus, la nouvelle technique devrait être largement utilisée dans les expériences visant à étudier le mécanisme d’action de la progérine.
Rodriguez S, Coppedè F, Sagelius H et Erikson M. « Expression accrue du transcrit de la lamine A tronquée du syndrome de progéria de Hutchinson-Gilford au cours du vieillissement cellulaire ». Journal européen de génétique humaine (2009), 1-10.
Août et octobre 2008 : La progéria est-elle réversible ? Deux publications récentes montrent que les FTI et la thérapie génique pourraient avoir cet effet !
Deux études distinctes montrent que la progéria est réversible dans le système cardiovasculaire et la peau de modèles de souris. Les expériences ont été significatives dans la mesure où les souris n'ont pas été traitées avant qu'elles n'expriment les symptômes de la progéria, alors que la plupart des études précédentes ont commencé le traitement avant que la progéria ne soit apparente. La production de progérine (la protéine nocive produite à partir du gène de la progéria) a été inhibée soit par traitement avec un inhibiteur de la farnésyltransférase (FTI) soit par désactivation du gène. Dans les deux cas, les souris sont revenues à des conditions normales ou presque normales. Ces observations fournissent des preuves encourageantes pour l'essai clinique actuel sur les FTI pour la progéria.
Dans une démonstration étonnante des progrès réalisés avec le médicament FTI, désormais utilisé dans le Premier essai clinique d'un médicament contre la progéria – L’équipe de recherche du Dr Francis Collins aux National Institutes of Health* a découvert que les FTI prévenaient et même inversaient l’effet le plus dévastateur de la progéria chez les souris : les maladies cardiovasculaires.* « Nous avons été étonnés de voir que [le médicament] fonctionnait si bien », déclare Francis Collins, généticien et ancien directeur du National Human Genome Research Institute, qui était l’auteur principal de l’équipe de recherche qui a identifié la mutation du gène de la progéria en 2003. « Non seulement ce médicament a empêché ces souris de développer une maladie cardiovasculaire, mais il a inversé les dommages chez les souris qui étaient déjà atteintes de la maladie. »
Les souris atteintes de Progeria développent une maladie cardiaque qui ressemble à celle des enfants atteints de Progeria. Les auteurs ont découvert que le FTI était à la fois capable de prévenir le développement de maladies cardiaques dans une certaine mesure lorsque les souris étaient traitées dès leur sevrage, et d’inverser partiellement la maladie établie lorsque les souris étaient traitées à partir de l’âge de 9 mois. « L’une des choses les plus frappantes de mon point de vue était la capacité à inverser la maladie », a déclaré Collins, ce qui est essentiel étant donné que la Progeria n’est généralement pas diagnostiquée à la naissance, mais seulement lorsque les enfants commencent à présenter des symptômes, alors qu’une partie des dommages a déjà été faite.
« Si ces médicaments s’avèrent avoir des effets similaires chez les enfants, cela pourrait constituer une avancée majeure dans le traitement de cette maladie dévastatrice », a déclaré le Dr Nabel du NHLBI, co-auteur de l’étude. « De plus, ces résultats mettent en lumière le rôle potentiel des médicaments FTI dans le traitement d’autres formes de maladie coronarienne. »
Voir l'article en Scientifique américain« Un nouvel espoir pour la progéria : un médicament pour une maladie rare liée au vieillissement », à https://www.sciam.com/article.cfm?id=new-hope-for-progeria-drug-for-rare-aging-disease et le communiqué de presse du NIH à https://www.nih.gov/news/health/oct2008/nhgri-06.htm
* Capell et al., « Un inhibiteur de la farnésyltransférase prévient à la fois l’apparition et la progression tardive des maladies cardiovasculaires dans un modèle murin de Progeria. » Actes de l'Académie nationale des sciences, Vol. 105, no. 41, 15902-15907 (14 octobre 2008)
Dans une deuxième étude publiée en ligne dans le Journal of Medical Genetics**, l'équipe de recherche du Dr Maria Eriksson au Karolinska Institutet en Suède a créé un autre modèle murin de progéria présentant des anomalies de la peau et des dents. Les souris ont été génétiquement modifiées de manière à ce que la mutation de la progéria puisse être désactivée à tout moment. Une fois la maladie apparue, le gène de la progéria était désactivé. Au bout de 13 semaines, la peau était presque impossible à distinguer de la peau normale. Cette étude montre que dans ces tissus, l'expression de la mutation de la progéria ne provoque pas de dommages irréversibles et que l'inversion de la maladie est possible, ce qui est prometteur pour le traitement de la progéria.
**Eriksson, et. al., « Phénotype réversible dans un modèle murin du syndrome de Hutchinson-Gilford Progeria. » J. Med. Genet. publié en ligne le 15 août 2008 ; doi:10.1136/jmg.2008.060772
Pour acheter cet article, rendez-vous sur : https://jmg.bmj.com/cgi/rapidpdf/jmg.2008.060772v1
De nouvelles preuves du lien entre la progéria, le vieillissement normal et les maladies cardiaques
Ces études passionnantes de Capell et Eriksson montrent qu’au-delà de la progéria, ces résultats pourraient bénéficier à tous les patients atteints de maladies cardiovasculaires. Les chercheurs ont découvert que la protéine toxique responsable de la progéria est en fait produite à de faibles niveaux chez tous les humains, et qu’elle s’accumule peut-être avec l’âge. Ainsi, en étudiant ces enfants rares, nous pouvons approfondir notre compréhension d’un mécanisme majeur du vieillissement humain et peut-être trouver de nouvelles façons de ralentir le processus.

