Гранттар қаржыландырылады
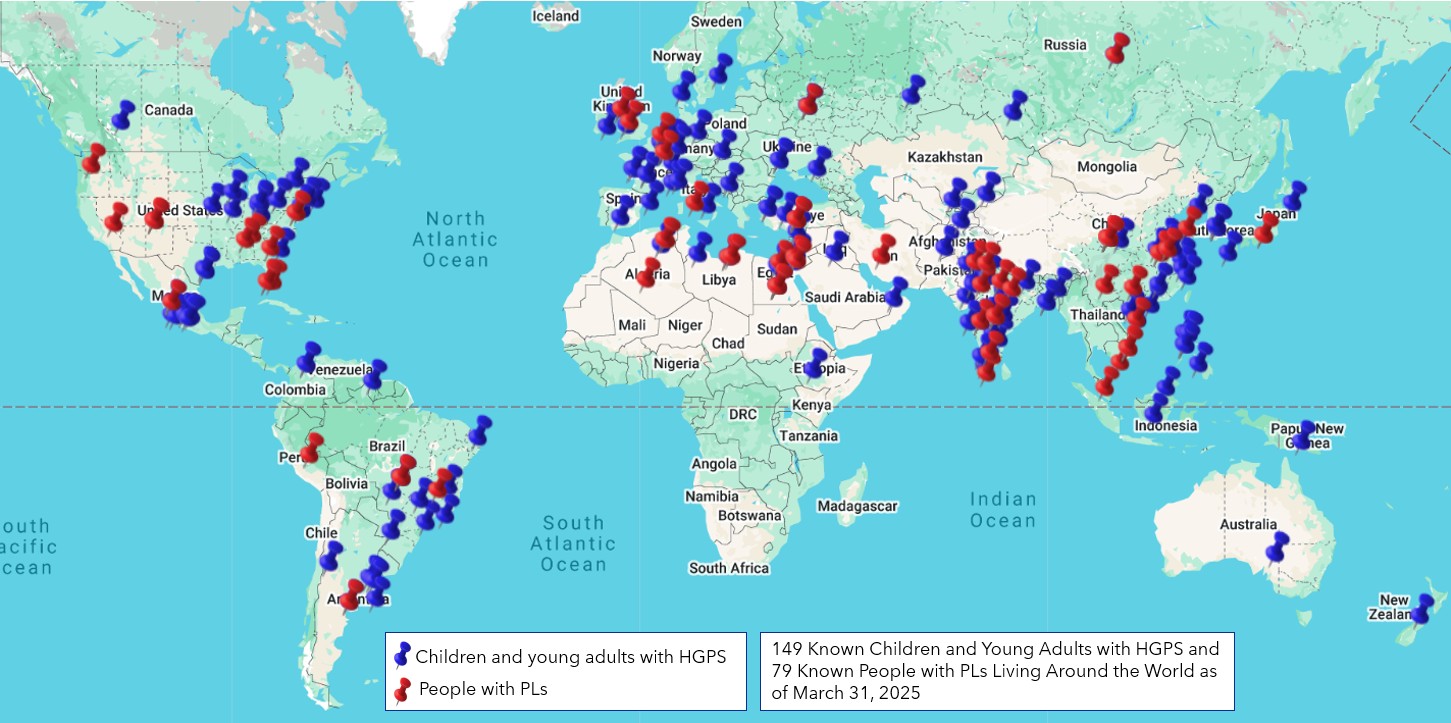
1999 жылы құрылғаннан бері PRF 18 штатта және 14 басқа елде орындалған Прогерияға қатысты ғылыми жобаларға 85 грантты қаржыландыру үшін $9,1 миллионнан астам қаржы бөлді!
Бізде қаржыландырылған гранттар және зерттеушілердің биологиялық эскиздері
- 2023 жылдың наурызы: дейін Рикардо Вилла-Беллоста, Сантьяго-де-Компостела, Испания. «Прогерия және тамырлы кальцинация: диета және емдеу».
- 2022 жылдың қарашасы: Сильвия Ортега Гутьерреске, Комплютенс университеті, Мадрид Испания
«Прогерияны емдеудің жаңа тәсілі ретінде шағын молекулалар арқылы прогерин деңгейін төмендету» - 2022 жылдың қазаны: Лоуренс Арбибеге, Institut Necker-Enfants Malades (INEM), Париж, Франция
«HGPS физиопатологиясындағы жеделдетілген ішек қартаюын шешу: интеграциялық тәсіл» - 2022 жылдың қаңтары: Карима Джабали, Мюнхен техникалық университеті, Мюнхен, Германия.
«Хатчинсон-Гилфорд Прогерия синдромын FDA мақұлдаған біріктірілген екі дәрі – Лонафарниб және Барицитиниб, сәйкесінше фарнезилтрансфераза және JAK1/2 киназаның спецификалық тежегіштерімен емдеу» - 2021 жылдың шілдесі: Chiara Lanzuolo, Instituto Nazionale Genetica Molecolare, Милан, Италия.
«Хатчинсон Гилфорд Прогерия синдромындағы фармакологиялық емдеу кезінде геномдық құрылым мен функцияның қалпына келуін бақылау» - 2021 жылдың шілдесі: Марио Кордеро, Кадис биомедициналық зерттеу және инновациялық институты (INIBICA), Кадис, Испания. «HGPS емдеудегі қабынуды тежеу және полипил стратегиясы»
- 2020 жылдың шілдесі (басталу күні 2020 жылдың тамызы) Эльза Логариньоға, Қартаю және анеуплоидия тобы, IBMC – Instituto de Biologia Molecular e Celular, Порту, Португалия, «HGPS үшін сенотерапевтикалық стратегия ретінде хромосомалық тұрақтылықтың шағын молекулалы күшеюі»
- 2020 жылдың қаңтары (басталу күні 2020 жылдың ақпаны): доктор Висенте Андреске, PhD, Centro Nacional de Investigaciones Cardiovasculares (CNIC), Мадрид, Испания. «Клиникаға дейінгі сынақтар үшін HGPS юкатан шағын шошқаларын өсіру үшін трансгендік Lamin C-Stop (LCS) және CAG-Cre юкатан шағын шошқаларының генерациясы»
- 2020 жылдың қаңтары (басталу күні 2020 жылдың тамызы): доктор Джованна Латтанциге, PhD, CNR Молекулярлық-генетика институтының Болонья бөлімшесі, Италия. «Прогериядағы өмір сапасын жақсарту: LmnaG609G/G609G тышқан үлгісіндегі алғашқы сынақ»
- 2020 жылдың қаңтары (басталу күні 2020 жылдың ақпаны): доктор Бум-Джун Паркке, PhD, Пусан Ұлттық университеті, Корея Республикасы. «Прогеринин (SLC-D011) және лонафарнибтің HGPS-ке әсері: in Vitro және in Vivo біріктірілген».
- 2020 жылдың қаңтары (басталу күні 2020 жылдың қаңтары): Дэвид Р. Лю, PhD, Ричард Меркин атындағы денсаулық сақтаудағы трансформациялық технологиялар институтының профессоры және директоры, химиялық биология және терапевтік ғылымдар бағдарламасының директоры, негізгі институт мүшесі және факультет төрағасының орынбасары, Кең институт, тергеуші, Ховард Хьюз медициналық институты, Томас Дадли Кабот жаратылыстану ғылымдарының профессоры және профессор Химия және химиялық биология, Гарвард университеті. «HGPS үшін өңдеудің негізгі әдістері».
- 2019 жылдың желтоқсаны (басталу күні 2019 жылдың желтоқсаны): Доктор Абигейл Бухвалтерге, PhD, Калифорния Сан-Франциско университеті. «HGPS үшін терапия ретінде прогерин клиренсінің орындылығын анықтау».
- 2019 жылдың қазан айы (басталу күні 2019 жылдың қарашасы): Доктор Колин Стюартқа, PhD, Медициналық биология институты, Иммунос, Сингапур. «Прогерияны басу үшін LINC-ті бұзу».
- 2019 жылдың маусымы (басталу күні 2019 жылдың қазаны): Доктор Мартин Бергоге, PhD докторы, Каролинска институтының профессоры, Хаддинге. «HGPS терапиясы үшін ICMT ингибиторларын әзірлеу және клиникаға дейінгі тестілеу».
- 2017 жылдың қарашасы (басталу күні 2017 жылдың қарашасы): Доктор Ричард К. Ассоянға, PhD докторы, Пенсильвания университетінің профессоры, Филадельфия, ПА. «HGPS-тегі артериялық қаттылықты талдау және әлсірету: өмір сүру ұзақтығына әсер».
- Қыркүйек 2017 (басталу күні 2017 жылдың қазаны): Доктор Торен Финкельге MD/PhD, Қартаю институтының директоры, Питтсбург, Пенсильвания. «Тамырлық аутофагия және HGPS прогрессиясы».
- 2016 жылғы желтоқсан (басталу күні 2017 жылғы 1 ақпан): Хуан Карлос Белмонте Изписуаға, PhD докторы, профессор, The гендік экспрессия зертханасы Салк биологиялық зерттеулер институты, Ла Джолла, Калифорния, АҚШ. Ол бұрынғы директор және оны құруға көмектесті Барселонадағы регенеративті медицина орталығы. Оның Ph.D. Биохимия және фармакология бойынша Болонья университетінен, Италиядан және Валенсия университетінен, Испаниядан. Ол Гейдельберг, Германия және UCLA, АҚШ, Марбург университетінің Еуропалық молекулярлық биология зертханасының (EMBL) докторантурасының ғылыми қызметкері. «Хатчинсон-Гилфорд Прогерия синдромындағы ерте қартаю фенотиптерін жақсарту».
- 2016 жылғы желтоқсан (басталу күні 2017 жылғы 1 ақпан): Рикардо Вилла-Беллоста, PhD, топ жетекшісі, Fundación Хименес Диас университетінің ауруханасының денсаулық зерттеу институты (FIIS-FJD, Испания). «HGPS-тегі қалыпты пирофосфат гомеостазын қалпына келтірудің терапиялық стратегиялары».
- 2016 жылғы желтоқсан (басталу күні 2017 жылғы 1 ақпан): Изабелла Саджиоға, PhD докторы, Сапиенца университетінің генетика және гендік терапия кафедрасының доценті (Рим, Италия). «HGPS ішіндегі ламинмен әрекеттесетін теломерлік ақуыз AKTIP».
- 2016 жылғы желтоқсан (басталу күні 2017 жылғы 1 наурыз): Том Мистели, PhD, NIH Құрметті тергеушісі және NIH Ұлттық онкологиялық институтының онкологиялық зерттеулер орталығының директоры. «Үміткер HGPS терапевтикасын in vivo тестілеу».
- 2016 жылдың тамызы (басталу күні 2017 жылдың 1 қаңтары): Сильвия Ортега-Гутьерреске, Университет Комплютенсе де Мадрид, Испания: 2013 жылдан бастап доцент; Рамон и Кажал стипендиаты, органикалық химия бөлімі, 2008-2012; PhD, 2004; Профессор Мария Луз Лопес-Родригестің жетекшілігімен, Фулбрайттың Медициналық химия бөлімінің стипендиаты, Проф. Бен Краватттың зертханасы, Химиялық биология және протеомика, Калифорниядағы Скриппс зерттеу институты, АҚШ; «Прогерияны емдеуге арналған жаңа изопренилцистеин карбоксилметилтрансфераза (ICMT) ингибиторлары.
- 2016 жылдың шілдесі (басталу күні 2016 жылдың 1 қазаны): Роланд Фойснерге, PhD, биохимия профессоры, Вена медициналық университеті және Макс Ф.Перутц зертханасы директорының орынбасары, Вена, Австрия. Ғылыми үйлестіруші, бұрынғы еуропалық желілік жоба EURO-Laminopathies және Бас редактор, Nucleus журналы; «Эндотелий жасушаларының дисфункциясының прогериядағы жүрек-қан тамырлары ауруларына қосқан үлесі және диагностикалық және емдік мақсаттарға әсері».
- 2015 жылғы желтоқсан (басталу күні 2016 жылғы 1 қаңтар): Хуан Карлос Белмонте Изписуа, PhD, профессор, Биологиялық зерттеулер Салк институтының ген экспрессиясы зертханасы, Ла Джолла, Калифорния, АҚШ. «Хатчинсон-Гилфорд Прогерия синдромын емдеуге арналған потенциалды терапевтік қосылыстарды анықтау және растау үшін жаңа технологияларды пайдалану».
- 2015 жылғы желтоқсан (басталу күні 2016 жылғы 1 наурыз): Джед Уильям Фахиге, ғылым кандидаты, Куллман химиопротекция орталығының директоры, доцент, Джонс Хопкинс университеті, Медицина мектебі, Медицина бөлімі, Клиникалық фармакология бөлімі, Фармакология және молекулалық ғылымдар бөлімі; Bloomberg Қоғамдық денсаулық сақтау мектебі, Халықаралық денсаулық сақтау департаменті, Адам тамақтану орталығы; «Өсімдік тектес изоцианаттардың сыйымдылығы сульфорафанның тиімділігінен асып түседі, Progeria жасушаларының улылығы төмендейді».
- 2015 жылдың маусымы (басталу күні 2015 жылдың 1 шілдесі): Бум-Джун Паркке, PhD докторы, Пусан ұлттық университетінің молекулалық биология кафедрасының төрағасы және профессоры, Корея Республикасы; «Прогерия синдромына қарсы JH4, прогерин-ламинді A/C байланыстыру тежегішінің емдік әсерін жақсарту».
- 2015 жылғы маусым (басталу күні 2015 жылғы 1 қыркүйек): Джон П. Кукқа, медицина ғылымдарының кандидаты, Джозеф К. «Расти» Уолтер және Кэрол Уолтер Лукеге Президенттің жүрек-қан тамырлары ауруларын зерттеу жөніндегі құрметті төрағасы, Хьюстон әдіскері ғылыми-зерттеу институтының жүрек-қан тамырлары ғылымдары бөлімінің төрағасы және толық мүшесі, жүрек-қан тамырлары орталығының директоры Регенерация Хьюстон әдіскері DeBakey Heart және тамыр орталығы, Хьюстон, Техас; «Прогерияға арналған теломераза терапиясы».
- 2015 жылғы маусым (басталу күні 2015 жылғы 1 қыркүйек): Фрэнсис Коллинзге, MD, PhD, Ұлттық денсаулық институтының директоры (NIH/NHGRI), Бетезда, MD; «HGPS зерттеулерін докторлықтан кейінгі қаржыландыру».
- 2015 жылғы маусым (басталу күні 2015 жылғы 1 қыркүйек): Дадли Ламминг, PhD, Висконсин-Мэдисон университетінің медицина кафедрасының ассистенті, UW медицина департаментінің тінтуірдің метаболикалық фенотиптеу платформасының тең директоры, Мэдисон, WI; «Арнайы диеталық амин қышқылдарын шектеу арқылы Прогерияға араласу».
- 2015 жылғы маусым (басталу күні 2015 жылғы 1 қыркүйек): Клаудиа Кавадасқа, PhD, Нейрология және жасушалық биология орталығы (CNC), Коимбра университеті, Португалия Коимбра; «Шеткі NPY HGPS фенотипін қайтарады: адамның фибробласттарында және тінтуір үлгісінде зерттеу»
- 2014 жылғы желтоқсан (басталу күні 2015 жылдың 1 сәуірі): Селия Александра Феррейра де Оливейра Авелейра, PhD, Нейрология және жасуша биологиясы орталығы (CNC) және Пәнаралық зерттеулер институты (IIIUC), Португалия Коимбра университеті; «Грелин: Хатчинсон-Гилфорд Прогерия синдромының фенотипін құтқару үшін жаңа терапевтік араласу»
- 2014 жылғы желтоқсан (басталу күні 2015 жылғы 1 ақпан): Хесус Васкес Кобосқа, PhD, Centro Nacional de Investigaciones Cardiovasculares, Мадрид, Испания; «Хатчинсон-Гилфорд прогериясы бар емделушілерден алынған прогероидты тышқан тіндеріндегі және айналымдағы лейкоциттердегі фарнецилденген прогериннің мөлшерін анықтау»
- 2014 жылғы желтоқсан (басталу күні 2015 жылғы 1 ақпан): Марша Мозеске, PhD, Бостон балалар ауруханасы, Бостон, MA; «Хатчинсон-Гилфорд прогерия синдромы үшін жаңа инвазивті емес биомаркерлерді ашу»
- 2014 жылғы желтоқсан (басталу күні 2015 жылғы 1 наурыз): Джозеф Рабиновицке, PhD, Темпл университетінің медицина мектебі, Филадельфия, Пенсильвания; «Адено-ассоциирленген вирус прогеринге қарсы жабайы типті ламин А және микроРНҚ-ның бірге жеткізілуін қамтамасыз етті»
- 2014 жылдың шілдесі (басталу күні 2014 жылдың 1 қарашасы): Висенте Андрес Гарсиаға, PhD, Centro Nacional de Investigaciones Cardiovasculares, Мадрид, Испания; «Тиімді клиникалық қолданбаларды әзірлеуді жеделдету үшін HGPS Knock-in Pig моделін құру».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Брайан Снайдерге, PhD,: Бет Израиль Диконес медициналық орталығы, Бостон, MA.; «G608G Progeria тышқан үлгісінің тірек-қимыл аппараты, бас-бет және тері фенотиптерінің сипаттамасы».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Роберт Голдманға, PhD, : Солтүстік-Батыс университеті; «Жасуша патологиясындағы прогериннің рөлі туралы жаңа түсініктер».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Кристофер Кэрроллға, PhD, : Йель университеті, Нью-Хейвен, CT.; «Ішкі ядролық мембрана ақуызы Man1 арқылы прогерин көптігінің реттелуі».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Катарин Ульманға: Юта университеті, Солт-Лейк-Сити, UT; «Прогериннің ДНҚ зақымдану реакциясындағы Nup153 рөліне қалай әсер ететінін анықтау».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Кэтрин Уилсонға: Джонс Хопкинс Медицина мектебі, Балтимор, MD; «Прогериннің табиғи экспрессиясы және төмендеген ламин А құйрық O-GlcNAциляциясының салдары».
- 2013 жылдың маусымы (басталу күні 2013 жылдың 1 қыркүйегі): Доктор Брайан Кеннедиге: Бак қартаюды зерттеу институты, Новато, Калифорния; «Прогериядағы шағын молекулалардың қартаюына араласу».
- 2012 жылдың желтоқсаны (басталу күні 2013 жылдың тамызы): Доктор Джерардо Фербейрге, PhD, Монреаль университеті, Монреаль, Канада: «Серинде 22 дефарнесилдену және фосфорлану арқылы прогерин клиренсін бақылау»
- 2012 жылдың желтоқсаны (басталу күні 2013 жылдың ақпаны): Доктор Томас Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD: «HGPS-тегі шағын молекулалардың ашылуы»
- 2012 жылдың желтоқсаны (басталу күні 2013 жылдың сәуір немесе мамыры): Карима Джабали, PhD, Мюнхен техникалық университеті, Мюнхен, Германия: «Жасуша циклінің прогрессиясы кезіндегі прогерин динамикасы»
- 2012 жылдың қыркүйек айы: Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD; Техник сыйлығы
- 2012 жылдың шілдесі (басталу күні 2012 жылдың 1 қыркүйегі): Висенте Андрес Гарсиаға, PhD, Centro Nacional de Investigaciones Cardiovasculares, Мадрид, Испания; «Фарнесилденген прогеринді сандық анықтау және аберрантты белсендіретін гендерді анықтау LMNA Хатчинсон-Гилфорд прогерия синдромындағы сплайсинг»
- 2012 жылдың шілдесі (басталу күні 2012 жылдың 1 қыркүйегі): Доктор Самуэль Бенчимолға, Йорк университеті, Торонто, Канада: «HGPS-тің мерзімінен бұрын қартаюына p53 қатысуы»
- 2012 жылдың шілдесі: Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD; Мамандық марапатына түзету
- 2011 жылғы желтоқсан (басталу күні 2012 жылдың 1 наурызы): Доктор Томас Дехатқа, PhD, Вена медициналық университеті, Австрия; «Прогериннің тұрақты мембраналық ассоциациясы және pRb сигнализациясының салдары
- 2011 жылғы желтоқсан (басталу күні 2012 жылдың 1 наурызы): Мария Эриксонға, PhD, Каролинская институты, Швеция; Прогерия ауруының қалпына келу мүмкіндігін талдау
- 2011 жылғы желтоқсан (басталу күні 2012 жылдың 1 наурызы): Колин Л. Стюарт Д.Филге, Медициналық биология институты, Сингапур; «Прогериядағы тамырлардың тегіс бұлшықеттерінің нашарлауының молекулярлық негізін анықтау
- 2011 жылдың қыркүйегі (басталу күні 2012 жылдың 1 қаңтары): Доктор Дилан Таатжеске, Колорадо университеті, Боулдер, КО: HGPS жасушаларының салыстырмалы метаболикалық профилін жасау және негізгі метаболиттерді модуляциялау кезіндегі фенотиптік өзгерістерді бағалау
- 2011 жылдың маусымы (басталу күні 2012 жылдың 1 қаңтары): Ян Ламмердингке, PhD докторы, Корнелл университетінің Вейл жасуша және молекулалық биология институты, Итака, Нью-Йорк; Хатчинсон-Гилфорд прогерия синдромындағы тамырлы тегіс бұлшықет жасушаларының дисфункциясы
- 2010 жылғы желтоқсан (басталу күні 2011 ж. 1 сәуір): Роберт Д. Голдманға, PhD, Солтүстік-Батыс Университетінің Медицина мектебі, Чикаго, Иллинойс; Прогериядағы В типті ламиндердің рөлі
- 2010 жылғы желтоқсан: Джон Грациоттоға, PhD, Массачусетс жалпы ауруханасы, Бостон, MA; Прогерин протеинін Хатчинсон-Гилфорд Прогерия синдромында емдік мақсат ретінде тазарту
- 2010 жылдың желтоқсаны (Басталу күні 2011 жылдың 1 сәуірі): Том Гловерге PhD, Ю Мичиган, Энн Арбор, MI; «Экзома секвенциясы арқылы прогерия және ерте қартаю гендерін анықтау»
- 2010 жылғы желтоқсан (басталу күні 2011 жылдың 1 наурызы): Юэ Зоуға, PhD, Шығыс Теннесси мемлекеттік университеті, Джонсон Сити, ТН; HGPS-тегі геномның тұрақсыздығының молекулалық механизмдері
- 2010 жылғы желтоқсан (басталу күні 2011 жылдың 1 қаңтары): Кан Цаоға, PhD, Мэриленд университеті, Колледж Парк, MD; Рапамицин Хатчинсон Гилфорд Прогерия синдромында жасушалық фенотипті және күшейтілген мутантты ақуызды тазартуды өзгертеді
- 2010 жылдың маусымы (басталу күні 2010 жылдың 1 қазаны): Евгений Макаровқа, PhD, Брунел университеті, Уксбридж, Ұлыбритания; Сплайсомалық кешендердің салыстырмалы протеомикасы арқылы LMNA сплайсинг реттегіштерін анықтау.
- 2009 жылдың қазаны: Джейсон Д. Лиебке, PhD, Солтүстік Каролина университеті, Chapel Hill NC; Гендер мен ламин А/прогерин арасындағы өзара әрекеттесу: Прогерия патологиясы мен емдеуін түсінуге арналған терезе
- 2009 жылдың қазаны: Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD; LMNA сплайсингінің кіші молекулалы модуляторларын анықтау
- 2009 жылдың тамызы: Уильям Л. Стэнфордқа, PhD, Торонто университеті, Канада
Тамыр функциясының төмендеуімен байланысты молекулалық механизмді түсіндіру үшін HGPS пациентінің фибробласттарынан алынған индукцияланған-плюрипотентті дің жасушалары (iPSC) - 2009 жылдың шілдесі: Якуб Толарға, Миннесота университеті, Миннеаполис, MN;
Гомологиялық рекомбинация арқылы адам прогериясы индукцияланған плюрипотентті жасушаларды түзету - Қыркүйек 2008 (басталу күні 2009 жылдың қаңтары): Крис Ноэль Далға, PhD докторы, Карнеги Меллон университеті, Питтсбург, Пенсильвания;
«Мембраналарға прогериннің тартылуын сандық анықтау» - 2007 жылдың қазаны: Майкл А. Гимброн, кіші, MD, Бригам және әйелдер ауруханасы және Гарвард медициналық мектебі, Бостон, MA эндотелий дисфункциясы және Хатчинсон-Гилфорд прогерия синдромындағы жедел атеросклероздың патобиологиясы
- 2007 жылғы қыркүйек (2008 жылдың қаңтары): Брайс М. Пасхалға, PhD, Вирджиния университетінің Медицина мектебі, Шарлоттсвилл, VA; Хатчинсон-Гильфорд прогерия синдромындағы ядролық көлік
- 2007 жылдың мамыры: Томас Н.Уайтқа, PhD, Бенароя ғылыми-зерттеу институты, Сиэтл, Вашингтон; Ламин AD50 экспрессиясының қантамырлардан тыс жасушалық матрица өндірісіне және тамырлы аурудың дамуына әсерін анықтау үшін HGPS тінтуірінің моделін пайдалану.
- 2007 жылдың наурызы: Джемима Барроуманға, PhD, Джон Хопкинс Медицина мектебі, Балтимор, MD; А ламинасын өңдеудің негізгі механизмі: HGPS қартаюының бұзылуына қатыстылығы
- 2006 жылдың тамызы: Чжунжун Чжоу, PhD, Гонконг университеті, Қытай. Ламинопатияға негізделген ерте қартаюдың дің жасушалары терапиясы
- 2006 жылдың тамызы: Майкл Синенскийге, PhD, Шығыс Теннесси мемлекеттік университеті, Джонсон Сити, ТН;
Прогериннің құрылымы мен белсенділігіне FTI-ның әсері - 2006 жылдың маусымы: Джан Ламмердингке, PhD, Бригам және әйелдер ауруханасы, Кембридж, MA; Хатчинсон-Гилфорд Прогерия синдромындағы ядролық механика мен механикалық трансдукцияның рөлі және фарнезилтрансфераза ингибиторын емдеудің әсері
- 2006 жылдың маусымы:Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD;
Pre-mRNA Splicing түзету арқылы HGPS үшін молекулалық терапия тәсілдері - 2005 жылдың маусымы: Лусио Комаиға, PhD, Оңтүстік Калифорния университеті, Лос-Анджелес, Калифорния; Хатчинсон-Гилфорд прогерия синдромының функционалдық талдауы
- 2005 жылдың маусымы: Лорен Дж. Фонгқа, PhD, Калифорния университеті, Лос-Анджелес, Калифорния;
Хатчинсон-Гилфорд прогерия синдромының себебін зерттеуге арналған жаңа тінтуір үлгілері - 2005 жылдың қаңтары: Доктор Карима Джабалиге, PhD, Колумбия университеті, Нью-Йорк, Нью-Йорк; HGPS жасушаларындағы ядролық функцияларға прогериннің басым теріс әсерін анықтау
- 2004 жылдың желтоқсаны: Роберт Д.Голдманға, PhD және Дэйл Шумакер, PhD, Солтүстік-Батыс университетінің медициналық мектебі, Чикаго, Иллинойс
Негізгі мутацияның ДНҚ репликациясындағы адам А ламинасының функциясына әсері - 2004 жылдың тамызы (2005 жылдың қаңтары): Стивен Янгқа, PhD, UCLA, Лос-Анджелес, Калифорния; «Прогерияны түсіну үшін тышқандардағы генетикалық эксперименттер» атты жобасы үшін.
- 2004 жылдың сәуірі: Моника Маллампалли, PhD және Сюзан Майклис, PhD, Джон Хопкинс Медицина мектебі, Балтимор, MD; «Прогериннің құрылымы, орналасуы және фенотиптік талдауы, HGPS-тегі преламин А мутантты түрі»
- 2003 жылдың желтоқсаны: Джоан Лемире, PhD, Тафтс университетінің медицина мектебі, Бостон, MA; «Хатчинсон-Гилфорд Прогерия синдромын зерттеу үшін тегіс бұлшықет жасушаларының моделін жасау: агрекан фенотиптің маңызды құрамдас бөлігі ме?»
- 2003 жылдың желтоқсаны: В.Тед Браунға, MD, PhD, FACMG, Даму кемістігі бойынша іргелі зерттеулер институты, Статен-Айленд, Нью-Йорк: «Прогериннің басым теріс мутация әсерлері»
- 2003 жылдың қыркүйек айы: Томас В. Гловерге, PhD докторы, Мичиган университеті, «
Хатчинсон-Гилфорд прогерия синдромындағы ламин А мутациясының рөлі» - 2002 жылдың мамыры: Сидней университетінің доценті Энтони Вайссқа, Австралия, жобаның тақырыбы: Хатчинсон-Гилфорд прогерия синдромының молекулалық маркерлеріне кандидат
- 2001 жылдың қаңтары (2001 жылдың шілдесі): Джон М. Седивиге, PhD Браун университеті, Провиденс, RI; & Джунко Ошима, MD, PhD, Вашингтон университеті, Сиэтл, WA, Соматикалық жасушаларды толықтыру арқылы Хатчинсон-Гилфорд прогерия синдромының генін клондау»
- желтоқсан 2001 (Басталу күні ақпан 2002): Томас В. Гловерге, PhD докторы, Мичиган университеті, «Хатчинсон-Гилфорд прогерия синдромындағы геномды қолдау»
- 2000 жылдың қаңтары: Лесли Б. Гордонға, MD, PhD, Тафтс университетінің медицина мектебі, Бостон, MA; «Хатчинсон-Гилфорд прогерия синдромындағы гиалурон қышқылының рөлі»
- 1999 жылдың тамызы: Лесли Б. Гордонға, MD, PhD, Тафтс университетінің медицина мектебі, Бостон, MA; «Артериосклероздың патофизиологиясы Хатчинсон-Гилфорд Прогерия синдромында»
2023 жылдың наурызы: Ricardo Villa-Bellosta's, Сантьяго-де-Компостела, Испания. «Прогерия және тамырлы кальцинация: диета және емдеу».
 Доктор Вилья-Беллоста зертханасындағы негізгі зерттеу бағыты жүрек-қантамыр жүйесінің, соның ішінде қолқаның, коронарлық артерияның және аорта қақпақшаларының шамадан тыс кальцинациясы болып табылады, бұл негізінен HGPS бар балалардың ерте өлімін анықтайды. HGPS-тегі қан тамырларының кальцинациясының молекулалық механизмі бұрын LmnaG609G/+ ұрып-соғатын тышқандарда талданған, олар кальцинацияның негізгі эндогендік тежегіші жасушадан тыс пирофосфаттың терең тапшылығын көрсетеді. Бұл жобада біз күнделікті тұтынылатын нақты қоректік заттардың маңыздылығына назар аудара отырып, HGPS-тегі тамырлардың кальцинациясын және ұзақ өмір сүруін қамтамасыз ететін немесе төмендететін молекулалық механизмдерді анықтауды мақсат етеміз. Сонымен қатар, біз HGPS тышқандары мен балалардың өмір сүру сапасын және ұзақ өмір сүруін жақсартуға мүмкіндік беретін екі жаңа әлеуетті терапиялық тәсілдің (пирофосфат гомеостазын қалпына келтіретін) тиімділігін талдауды жоспарлап отырмыз. Біз LmnaG609G/+ тінтуірді және аортаның тамырлы тегіс бұлшықет жасушаларын осы қоректік заттардың/емдеулердің қан тамырларының кальцинациясына және ұзақ өмір сүруіне in vivo әсерін талдау үшін жеке және FTI-лонафарнибпен біріктіруді жоспарлап отырмыз.
Доктор Вилья-Беллоста зертханасындағы негізгі зерттеу бағыты жүрек-қантамыр жүйесінің, соның ішінде қолқаның, коронарлық артерияның және аорта қақпақшаларының шамадан тыс кальцинациясы болып табылады, бұл негізінен HGPS бар балалардың ерте өлімін анықтайды. HGPS-тегі қан тамырларының кальцинациясының молекулалық механизмі бұрын LmnaG609G/+ ұрып-соғатын тышқандарда талданған, олар кальцинацияның негізгі эндогендік тежегіші жасушадан тыс пирофосфаттың терең тапшылығын көрсетеді. Бұл жобада біз күнделікті тұтынылатын нақты қоректік заттардың маңыздылығына назар аудара отырып, HGPS-тегі тамырлардың кальцинациясын және ұзақ өмір сүруін қамтамасыз ететін немесе төмендететін молекулалық механизмдерді анықтауды мақсат етеміз. Сонымен қатар, біз HGPS тышқандары мен балалардың өмір сүру сапасын және ұзақ өмір сүруін жақсартуға мүмкіндік беретін екі жаңа әлеуетті терапиялық тәсілдің (пирофосфат гомеостазын қалпына келтіретін) тиімділігін талдауды жоспарлап отырмыз. Біз LmnaG609G/+ тінтуірді және аортаның тамырлы тегіс бұлшықет жасушаларын осы қоректік заттардың/емдеулердің қан тамырларының кальцинациясына және ұзақ өмір сүруіне in vivo әсерін талдау үшін жеке және FTI-лонафарнибпен біріктіруді жоспарлап отырмыз.
2022 жылдың қарашасы: Сильвия Ортега Гутьерреске, Комплютенс университеті, Мадрид Испания
«Прогерияны емдеудің жаңа тәсілі ретінде шағын молекулалар арқылы прогерин деңгейін төмендету»
Соңғы дәлелдер Хатчинсон-Гилфорд прогерия синдромының (HGPS немесе прогерия) өлімге әкелетін жалғыз маңызды факторы прогерияны тудыратын А ламинасының мутацияланған түрі прогериннің жинақталуы екенін көрсетеді. Прогерин деңгейін оның РНҚ-мен әрекеттесу арқылы немесе гендік түзетуді орындау арқылы төмендетуге бағытталған генетикалық тәсілдер аурудың фенотипінде айтарлықтай жақсартуларды тудырады. Бұл жобада біз протеолизге бағытталған химералар (PROTACs) деп аталатын шағын молекулаларды жобалау және синтездеу арқылы прогеринді тікелей азайтуды қарастырамыз. Негізінен соңғы онжылдықта басқа аурулар үшін жасалған қосылыстардың бұл класы ақуызды арнайы байланыстыра алады және оны протеосомалық деградацияға белгілейді, сондықтан оның деңгейін төмендетеді. Біздің зертханада бұрын анықталған хиттен бастап, біз биологиялық белсенділік пен фармакокинетикалық параметрлері бойынша жақсартылған қосылыстарды алуға бағытталған дәрілік химия бағдарламасын жүзеге асыратын боламыз. Оңтайлы қосылыстар (қосылыстар) прогерияның in vivo үлгісінде тиімділік үшін бағаланады.
 2022 жылдың қазаны: Лоуренс Арбибеге, Institut Necker-Enfants Malades (INEM), Париж, Франция
2022 жылдың қазаны: Лоуренс Арбибеге, Institut Necker-Enfants Malades (INEM), Париж, Франция
«HGPS физиопатологиясындағы жеделдетілген ішек қартаюын шешу: интеграциялық тәсіл»
Жақында доктор Арбибенің зертханасы созылмалы қабынудың айтарлықтай өзгеретінін көрсеттіішектегі пре-мРНҚ сплайсингінің сапасын бақылау, оның салдарының бірі прогерин протеинін өндіру болып табылады. Бұл жобада ол прогериннің уыттылығының ішек эпителийіне әсерін зерттейді, дің жасушаларының жаңаруына және шырышты тосқауылдың тұтастығына әсерін бақылау. Ол сонымен қатар HGPS-те РНҚ сплайсингіне әсер ететін қартаюға қарсы экологиялық белгілерді анықтауға мүмкіндік беретін репортер тінтуірінің үлгісін енгізу арқылы мақсат етеді. in vivo прогеринге тән сплайсинг оқиғасын қадағалау. Тұтастай алғанда, бұл жоба прогерия ауруының ішектің тұтастығына тигізетін салдарын қарастырады, сонымен бірге ғылыми қоғамдастыққа HGPS-те жедел қартаюдың ұлпалар мен жасушаға тән драйверлерін зерттеуге арналған жаңа ресурстарды ұсынады.

2022 жылдың қаңтары: Карима Джабали, PhD, Мюнхен техникалық университеті, Мюнхен, Германия: «Хатчинсон-Гилфорд прогерия синдромын FDA мақұлдаған біріктірілген екі дәрімен емдеу — Лонафарниб және Барицитиниб, сәйкесінше фарнезилтрансфераза және JAK1/2 киназаның спецификалық тежегіштері.
Доктор Джабалидің жобасы тінтуірдің үлгісінде HGPS комбинациясы арқылы емдеуді тексереді Лонафарниб және барицитиниб, қабынуға қарсы препарат типтік HGPS патологияларының дамуын кешіктіреді, атап айтқанда тамыр аурулары, тері атрофиясы, алопеция және липодистрофия. Оның алдыңғы нәтижелері JAK-STAT жолын HGPS қабыну және жасушалық ауру ерекшеліктерімен байланыстырады. Барицитинибтің HGPS жасушалық әсері жасуша өсуін және митохондриялық функцияны жақсартты, қабынуға қарсы факторларды азайтты, прогерин деңгейін төмендетті және адипогенезді жақсартты. Сонымен қатар, барицитинибті лонафарнибпен бірге қабылдау тек лонафарнибке қарағанда кейбір жасушалық фенотиптерді жақсартты.

2021 жылдың шілдесі: Chiara Lanzuolo, Instituto Nazionale Genetica Molecolare, Милан, Италия.
«Хатчинсон Гилфорд Прогерия синдромындағы фармакологиялық емдеу кезінде геномдық құрылым мен функцияның қалпына келуін бақылау»
Д-р Ланзуоло ДНҚ 3D құрылымы саласындағы сарапшы. Жақында оның тобы геномның жасушаға тән үш өлшемді құрылымы ядролық ламинаның дұрыс жиналуымен ұсталады және прогерияның патогенезінде тез жоғалады деп хабарлады. Бұл жобада ол патологияның басталуына мүмкіндік беретін немесе тездететін аурудың ерте кезеңдерінде орын алатын молекулалық механизмдерді нақты шешу үшін прогерикалық тінтуір үлгісінде озық технологияларды қолданады. Сонымен қатар, ол фармакологиялық емдеу кезінде функционалдық геномды қалпына келтіруді талдайды.
 2021 жылдың шілдесі: Марио Кордеро, Кадис биомедициналық зерттеу және инновациялық институты (INIBICA), Кадис, Испания.
2021 жылдың шілдесі: Марио Кордеро, Кадис биомедициналық зерттеу және инновациялық институты (INIBICA), Кадис, Испания.
«HGPS емдеудегі қабынуды тежеу және полипил стратегиясы»
Доктор Кордероның жобасы Прогерияның патофизиологиясындағы NLRP3-қабыну кешенінің молекулалық салдарын зерттейді және NLRP3-қабынуының арнайы тежегішінің лонафарнибпен әсерін зерттейді. Оның алдыңғы нәтижелері NLRP3-тің ықтимал рөлін және оның тежелуінің Progeria тышқан үлгісінің өмір сүруіне ықтимал әсерін көрсетеді. Ол енді қайсысы тиімді екенін анықтау үшін лонафарнибті бір реттік дәрілік емдеуді NLRP3 арнайы тежегішімен және екеуінің аралас емімен салыстырады. Бұл жобаның нәтижелері адамның 2a фазасындағы сынақтарында жақсы әсер және төзімділікпен сыналған екі қосылысты пайдаланып, Прогериядағы клиникалық сынақты жеделдетуге көмектеседі деп үміттенеміз.

2020 жылдың шілдесі: (басталу күні 2020 жылдың тамызы) Эльза Логариньоға, Қартаю және анеуплоидия тобы, IBMC – Instituto de Biologia Molecular e Celular, Порту, Португалия, «HGPS үшін сенотерапевтикалық стратегия ретінде хромосомалық тұрақтылықтың шағын молекулалы күшеюі»
Доктор Логариньоның жобасы HGPS жасушалық және физиологиялық ерекшеліктеріне қарсы тұру үшін микротүтікшенің (МТ) депополимеризациялаушы кинезин-13 Kif2C/MCAK (UMK57) шағын молекулалы агонистінің әсерін зерттеуге бағытталған. Оның алдыңғы нәтижелері Kif2C-ні геномдық және хромосомалық тұрақсыздықтың негізгі ойыншысы ретінде бағалайды, олар себепті байланысқан, сонымен қатар прогероидты синдромдардың негізгі себептері ретінде белгіленген. Прогерия хромосомаларын жасушалық деңгейде тұрақтандыру бүкіл денедегі ауруды жақсартуға бағытталған.
 2020 жылдың қаңтары: доктор Висенте Андреске, PhD, Centro Nacional de Investigaciones Cardiovasculares (CNIC), Мадрид, Испания. «Клиникаға дейінгі сынақтар үшін HGPS юкатан шағын шошқаларын өсіру үшін трансгендік Lamin C-Stop (LCS) және CAG-Cre юкатан шағын шошқаларының генерациясы»
2020 жылдың қаңтары: доктор Висенте Андреске, PhD, Centro Nacional de Investigaciones Cardiovasculares (CNIC), Мадрид, Испания. «Клиникаға дейінгі сынақтар үшін HGPS юкатан шағын шошқаларын өсіру үшін трансгендік Lamin C-Stop (LCS) және CAG-Cre юкатан шағын шошқаларының генерациясы»
Доктор Андрестің зертханасындағы зерттеудің негізгі бағыты Прогерияның жаңа жануарлар үлгілерін жасауға бағытталған. Жануарлардың үлкен үлгілері тышқан үлгілеріне қарағанда адам ауруының негізгі белгілерін жақсырақ қайталайды, бұл жүрек-қан тамырлары ауруларын зерттеуге және емдеу әдістерін сынауға мүмкіндік береді. Доктор Андрестің моделі бұрын PRF қаржыландырған Progeria жаңа минипиг үлгісін жақсартады.
 2020 жылдың қаңтары: доктор Джованна Латтанциге, PhD, CNR Молекулярлық-генетика институтының Болонья бөлімшесі, Италия. «Прогериядағы өмір сапасын жақсарту: LmnaG609G/G609G тышқан үлгісіндегі алғашқы сынақ»
2020 жылдың қаңтары: доктор Джованна Латтанциге, PhD, CNR Молекулярлық-генетика институтының Болонья бөлімшесі, Италия. «Прогериядағы өмір сапасын жақсарту: LmnaG609G/G609G тышқан үлгісіндегі алғашқы сынақ»
Доктор Латтанзи созылмалы қабыну күйімен байланысты Прогерияның өмір сүру сапасына тоқталады. Қабыну жағдайын қалыпқа келтіру пациенттерге фармакологиялық емдеуге көмектесуі мүмкін; егер олардың денсаулық жағдайы жақсарса, олар тиімділікке қол жеткізе алады және өмір сүру ұзақтығын ұзартады. Доктор Латтанзи нәтижелерді пациенттерге беру мақсатында Progeria тінтуірінің үлгісінде созылмалы қабынуды азайту стратегияларын сынайтын болады.
 2020 жылдың қаңтары: доктор Бум-Джун Паркке, PhD, Пусан Ұлттық университеті, Корея Республикасы. «Прогеринин (SLC-D011) және лонафарнибтің HGPS-ке әсері: in Vitro және in Vivo біріктірілген».
2020 жылдың қаңтары: доктор Бум-Джун Паркке, PhD, Пусан Ұлттық университеті, Корея Республикасы. «Прогеринин (SLC-D011) және лонафарнибтің HGPS-ке әсері: in Vitro және in Vivo біріктірілген».
Доктор Парк прогеринді тежейтін және тышқандардағы прогерия жасушаларында ауруды тежейтін прогеринин деп аталатын дәрі ойлап тапты. Доктор Парк енді прогерининнің лонафарнибпен синергетикалық әсерін зерттейді. Қайсысы ең тиімді екенін анықтау үшін ол бір дәрілік емді (лонафарниб) және аралас емді (прогеринин және лонафарниб) салыстырады. Егер дәрілік комбинацияның уыттылығы төмен болса, прогеринин мен лонафарнибтің біріктірілген клиникалық сынағы көкжиекте болуы мүмкін!
 2020 жылдың қаңтары: Дэвид Р. Лю, PhD, Ричард Меркин профессоры және денсаулық сақтаудағы Трансформациялық технологиялар институтының директоры, Химиялық биология және терапиялық ғылымдар бағдарламасының директоры, Core институтының мүшесі және факультет төрағасының орынбасары, Кең институт, тергеуші, Ховард Хьюз Медицина институты, Томас Дадли Кабот жаратылыстану ғылымдарының профессоры және профессор Химия және химиялық биология, Гарвард университеті. «HGPS үшін өңдеудің негізгі әдістері».
2020 жылдың қаңтары: Дэвид Р. Лю, PhD, Ричард Меркин профессоры және денсаулық сақтаудағы Трансформациялық технологиялар институтының директоры, Химиялық биология және терапиялық ғылымдар бағдарламасының директоры, Core институтының мүшесі және факультет төрағасының орынбасары, Кең институт, тергеуші, Ховард Хьюз Медицина институты, Томас Дадли Кабот жаратылыстану ғылымдарының профессоры және профессор Химия және химиялық биология, Гарвард университеті. «HGPS үшін өңдеудің негізгі әдістері».
Доктор Лю зертханасы патогендік G608G аллелін жабайы типті LMNA-ға қайтару үшін жаңа базалық редактор нұсқаларын сынауды және валидациялауды, осы редакторды және тиісті бағыттаушы РНҚ-ны пациенттерден алынған жасушаларға жеткізу үшін вирустарды әзірлеу және өндіруді, әзірлеуді және өндіруді жүзеге асырады. осы редакторды және тиісті бағыттаушы РНҚ in vivo, мақсаттан тыс ДНҚ және мақсаттан тыс РНҚ талдауларын, РНҚ және ақуыз талдауларын жеткізу үшін вирустардың емделген емделушіден алынған жасушалар және қосымша эксперименттер мен талдаулар қажет
 2019 жылдың желтоқсаны: Доктор Абигейл Бухвалтерге, Сан-Францискодағы Калифорния университетінің жүрек-қан тамырлары ғылыми-зерттеу институтының және физиология кафедрасының ассистенті профессоры. Бухвалтер зертханасындағы жобалар жасуша түрлері бойынша ядролық ұйымды құруды, мамандандыруды және қызмет көрсетуді басқаратын механизмдерді анықтауға бағытталған. Ядролық ламинаның ядродағы геномды ұйымдастыруға нұсқау берудегі және бұл тәртіптің аурумен байланысты мутациялармен қалай бұзылатынын анықтаудағы рөлі ерекше қызығушылық тудырады.
2019 жылдың желтоқсаны: Доктор Абигейл Бухвалтерге, Сан-Францискодағы Калифорния университетінің жүрек-қан тамырлары ғылыми-зерттеу институтының және физиология кафедрасының ассистенті профессоры. Бухвалтер зертханасындағы жобалар жасуша түрлері бойынша ядролық ұйымды құруды, мамандандыруды және қызмет көрсетуді басқаратын механизмдерді анықтауға бағытталған. Ядролық ламинаның ядродағы геномды ұйымдастыруға нұсқау берудегі және бұл тәртіптің аурумен байланысты мутациялармен қалай бұзылатынын анықтаудағы рөлі ерекше қызығушылық тудырады. 2019 жылдың қазан айы: Прогерияны зерттеу саласында тәжірибелі зерттеуші доктор Стюартқа. Соңғы онжылдықта оның зерттеулері қартаюға, жүрек-қан тамырлары қызметіне және бұлшықет дистрофиясына әсер ететін LaminA геніндегі мутациялардан туындайтын аурулардың гетерогенді жиынтығы ламинопатияларға бағытталған. Ол және оның әріптестері SUN1 деп аталатын ақуызды жою салмақ жоғалтуды кері қайтаратынын және прогерия тәрізді тышқандардың өмір сүруін арттыратынын көрсетті. Енді ол осы нәтижеге негізделген есірткі скринингін жүргізеді, SUN1-ді бұзатын және Прогериямен ауыратын балаларды емдеу үшін жаңа дәрі ретінде қызмет ете алатын мыңдаған химиялық заттарды зерттейді.
2019 жылдың қазан айы: Прогерияны зерттеу саласында тәжірибелі зерттеуші доктор Стюартқа. Соңғы онжылдықта оның зерттеулері қартаюға, жүрек-қан тамырлары қызметіне және бұлшықет дистрофиясына әсер ететін LaminA геніндегі мутациялардан туындайтын аурулардың гетерогенді жиынтығы ламинопатияларға бағытталған. Ол және оның әріптестері SUN1 деп аталатын ақуызды жою салмақ жоғалтуды кері қайтаратынын және прогерия тәрізді тышқандардың өмір сүруін арттыратынын көрсетті. Енді ол осы нәтижеге негізделген есірткі скринингін жүргізеді, SUN1-ді бұзатын және Прогериямен ауыратын балаларды емдеу үшін жаңа дәрі ретінде қызмет ете алатын мыңдаған химиялық заттарды зерттейді.
 2017 жылдың қарашасы: доктор Мартин Бергоға, PhD, биоғылымдар профессоры, Каролинска институты, Стокгольм. «HGPS терапиясы үшін ICMT ингибиторларын әзірлеу және клиникаға дейінгі тестілеу». Доктор Бергоның зерттеулері прогеринді өңдеуге қажетті фермент ICMT-ның төмендеуі Zmpste24 жетіспейтін, прогерия тәрізді тышқандардағы көптеген патологиялық белгілерді кері қайтарады деген тұжырымға негізделген. Оның алдын ала зерттеулері зертханада өсірілген Progeria жасушалары ICMT ингибиторларымен өңделген кезде тезірек және ұзағырақ өсетінін көрсетеді. Доктор Берго осы ферментті блоктайтын, сондықтан прогерин өндірісін тежейтін препараттарды сынап, Progeria тінтуірінің үлгілері препараттың осы түрімен емделгенде сау бола ма және ұзағырақ өмір сүре ме, соны іздейді.
2017 жылдың қарашасы: доктор Мартин Бергоға, PhD, биоғылымдар профессоры, Каролинска институты, Стокгольм. «HGPS терапиясы үшін ICMT ингибиторларын әзірлеу және клиникаға дейінгі тестілеу». Доктор Бергоның зерттеулері прогеринді өңдеуге қажетті фермент ICMT-ның төмендеуі Zmpste24 жетіспейтін, прогерия тәрізді тышқандардағы көптеген патологиялық белгілерді кері қайтарады деген тұжырымға негізделген. Оның алдын ала зерттеулері зертханада өсірілген Progeria жасушалары ICMT ингибиторларымен өңделген кезде тезірек және ұзағырақ өсетінін көрсетеді. Доктор Берго осы ферментті блоктайтын, сондықтан прогерин өндірісін тежейтін препараттарды сынап, Progeria тінтуірінің үлгілері препараттың осы түрімен емделгенде сау бола ма және ұзағырақ өмір сүре ме, соны іздейді. HGPS-тегі артериялық қаттылық: өмір сүру ұзақтығына әсер ету. Доктор Ассоян олардың зерттеулері HGPS артерияларының неліктен мерзімінен бұрын қатайтынын және фармакологиялық емдеу немесе тышқандардың генетикалық модификациясы арқылы ерте артериялық қатаюдың алдын алуға болатынын зерттейді деп санайды. Доктор Ричард Ассоян Джонс Хопкинс университетінде (BA), Чикаго университетінде (PhD) және Ұлттық денсаулық институттарында (докторантурадан кейінгі) білім алды. 1998 жылы Пенсильвания университетіне ауысқанға дейін Колумбия университеті мен Майами университетінің факультеттерінде болды. Қазіргі уақытта Медицина мектебінің жүйелік фармакология және трансляциялық терапия кафедрасының фармакология профессоры. Доктор Ассоянның зертханасы артериялық жасушадан тыс матрицаның қаттылығының өзгеруі артериялық тегіс бұлшықет жасушаларының қызметіне қалай әсер ететінін зерттейді. Осы ағымдағы зерттеуде оның зертханасы HGPS-те ерте артериялық қатаюдың негізі мен салдарын зерттеу үшін Progeria тінтуірінің үлгісін пайдаланады.
HGPS-тегі артериялық қаттылық: өмір сүру ұзақтығына әсер ету. Доктор Ассоян олардың зерттеулері HGPS артерияларының неліктен мерзімінен бұрын қатайтынын және фармакологиялық емдеу немесе тышқандардың генетикалық модификациясы арқылы ерте артериялық қатаюдың алдын алуға болатынын зерттейді деп санайды. Доктор Ричард Ассоян Джонс Хопкинс университетінде (BA), Чикаго университетінде (PhD) және Ұлттық денсаулық институттарында (докторантурадан кейінгі) білім алды. 1998 жылы Пенсильвания университетіне ауысқанға дейін Колумбия университеті мен Майами университетінің факультеттерінде болды. Қазіргі уақытта Медицина мектебінің жүйелік фармакология және трансляциялық терапия кафедрасының фармакология профессоры. Доктор Ассоянның зертханасы артериялық жасушадан тыс матрицаның қаттылығының өзгеруі артериялық тегіс бұлшықет жасушаларының қызметіне қалай әсер ететінін зерттейді. Осы ағымдағы зерттеуде оның зертханасы HGPS-те ерте артериялық қатаюдың негізі мен салдарын зерттеу үшін Progeria тінтуірінің үлгісін пайдаланады.
Доктор Финкель HGPS неліктен сегменттік прогерия екенін, атап айтқанда, неге басқа ұлпаларға қарағанда белгілі бір тіндерге көбірек әсер ететінін түсінуге тырысады. Ол әсіресе қан тамырларына байланысты проблемалардың неліктен пайда болатынына қызығушылық танытады. Аурудың сегменттік сипаты қан тамырларын жасауға көмектесетін жасуша, тамырлы тегіс бұлшықет жасушасы басқа жасуша түрлеріне қарағанда прогерин экспрессиясына сәл басқаша жауап беруі мүмкін деп саналады. Бұл айырмашылық аутофагияның жасушалық процесіне қатысатын p62 деп аталатын басқа ақуызға қатысты. Ол p62 тегіс бұлшықет жасушаларында басқа жасушалармен салыстырғанда (тегіс бұлшықет жасушаларында ол жасуша ядросында локализацияланған сияқты) басқаша әрекет етеді деп санайды және бұл айырмашылықтар қан тамырларының HGPS-те неге соншалықты көп проблемалары бар екенін түсіндіре алады. Ол сондай-ақ p62 әсер ететін медицина дамуы мүмкін және бұл препараттар HGPS пациенттерін емдеу үшін пайдалы болуы мүмкін деп санайды.
Торен Финкель – Питтсбург университетінің Қартаю институтының директоры/UPMC және Г. Николас Беквит III және Дороти Б. Беквит Питтсбург университетінің Медицина департаментінің трансляциялық медицина кафедрасының меңгерушісі. Ол 1986 жылы Гарвард медицина мектебінде физика бойынша бакалавр дәрежесін және MD және PhD дәрежесін алды. Массачусетс жалпы ауруханасында ішкі аурулар бойынша резидентурадан кейін Джонс Хопкинс медициналық мектебінде кардиология бойынша стипендиатты аяқтады. 1992 жылы ол Ұлттық жүрек, өкпе және қан институтының (NHLBI) ішкі зерттеу бағдарламасы аясында NIH-ке тергеуші ретінде келді. NIH-те жұмыс істеген уақытында ол әртүрлі қызметтерді атқарды, соның ішінде кардиология бөлімшесінің меңгерушісі және NHLBI құрамындағы молекулалық медицина орталығының бастығы. Ол Американдық клиникалық зерттеулер қоғамының (ASCR), американдық дәрігерлер қауымдастығының (AAP) мүшесі және американдық ғылымды дамыту қауымдастығының (AAAS) мүшесі. Ол көптеген редакциялық кеңестерде қызмет етеді, оның ішінде қазіргі уақытта шолу редакторлары кеңесінде қызмет етеді. Ғылым. NIH Intramural Funds негізінен оның жұмысын қолдағанымен, оның зертханасы Эллисон медициналық қорының аға стипендиаты және Leducq қорының қолдауына ие болды, ол қазір жүрек регенерациясын зерттейтін Трансатлантикалық желінің АҚШ-тың үйлестірушісі болып қызмет етеді. Оның қазіргі ғылыми қызығушылықтары аутофагия, реактивті оттегі түрлері және қартаю және жасқа байланысты аурулардағы митохондриялық функциялардың рөлін қамтиды.
 Жүрек-қантамыр жүйесіндегі өзгерістер Прогериямен ауыратындар арасында өлімнің негізгі себебі болып табылады. Доктор Изписуа Бельмонтенің зертханасы жасушаны қайта бағдарламалау Прогерияның жасушаларын жасарта алатынын көрсетті. Оның зертханасы қазір жүрек-қантамыр жүйесіне ерекше назар аудара отырып, Progeria тінтуірінің үлгілеріндегі қартаю фенотиптерін жақсарту үшін жасушалық қайта бағдарламалауды қолданады. Бұл ашылулар Прогерия науқастарын емдеудің жаңа әдістерін дамытуға әкелуі мүмкін.
Жүрек-қантамыр жүйесіндегі өзгерістер Прогериямен ауыратындар арасында өлімнің негізгі себебі болып табылады. Доктор Изписуа Бельмонтенің зертханасы жасушаны қайта бағдарламалау Прогерияның жасушаларын жасарта алатынын көрсетті. Оның зертханасы қазір жүрек-қантамыр жүйесіне ерекше назар аудара отырып, Progeria тінтуірінің үлгілеріндегі қартаю фенотиптерін жақсарту үшін жасушалық қайта бағдарламалауды қолданады. Бұл ашылулар Прогерия науқастарын емдеудің жаңа әдістерін дамытуға әкелуі мүмкін.
Доктор Изписуа Белмонтенің зерттеу саласы дің жасушаларының биологиясын, мүшелер мен тіндердің дамуы мен регенерациясын түсінуге бағытталған. Ол беделді, халықаралық деңгейде мойындалған, рецензияланған журналдар мен кітап тарауларында 350-ден астам мақалалар жариялады. Ол бірнеше атақты марапаттар мен марапаттарға ие болды, соның ішінде Уильям Клинтонның Президенттік сыйлығы, Pew Scholar сыйлығы, Ұлттық ғылым қорының шығармашылық сыйлығы, Американдық жүрек қауымдастығының құрылған тергеушісі сыйлығы және осы салалардағы күш-жігері үшін Роджер Гильемин Нобель төрағасы. Көптеген жылдар бойы оның жұмысы мүшелер мен тіндерді үлгілеу және спецификациялау кезінде кейбір гомеобокс гендерінің рөлін ашуға, сондай-ақ ішкі органдардың әртүрлі жасушалық түрінің прекурсорларының эмбриональды сол жақ бойымен кеңістікте қалай ұйымдастырылғанын анықтайтын молекулалық механизмдерді анықтауға ықпал етті. оң ось. Оның жұмысы бізге жоғары сатыдағы омыртқалы жануарларда органдардың регенерациясына, адамның бағаналы жасушаларының әртүрлі тіндерге дифференциациялануына, сондай-ақ қартаюға және қартаюға байланысты ауруларға әсер ететін молекулалық негізді көруге ықпал етеді. Оның зерттеуінің түпкі мақсаты – адамзатқа әсер ететін ауруларды емдеу үшін жаңа молекулалар мен арнайы гендік және жасушалық емдеу әдістерін жасау.
2016 жылғы желтоқсан (басталу күні 2017 жылғы 1 ақпан): Рикардо Вилла-Беллоста, PhD, топ жетекшісі, Fundación Хименес Диас университетінің ауруханасының денсаулық зерттеу институты (FIIS-FJD, Испания). «HGPS-тегі қалыпты пирофосфат гомеостазын қалпына келтірудің терапиялық стратегиялары».
 HGPS пациенттері сияқты, LmnaG609G/+ тышқандар ағзаның жасушадан тыс пирофосфатты (PPi) синтездеу қабілетінің бұзылуына байланысты шамадан тыс тамырлы кальцификацияны көрсетеді. Жасушадан тыс PPi деградациясы мен синтезі арасындағы теңгерімсіздік артикулярлық шеміршек пен басқа да жұмсақ тіндердің патологиялық кальцинациясына әкелуі мүмкін болғандықтан, прогерин экспрессиясымен байланысты айналымдағы PPi жүйелі төмендеуі тамырлардың кальцинациясын, сүйек пен буын аномалияларын қоса, бірнеше HGPS клиникалық көріністерін түсіндіруі мүмкін. Экзогенді PPi-мен емдеу қан тамырларының кальцинациясын төмендетті, бірақ Lmna өмір сүру ұзақтығын ұзартпады.G609G/G609G тышқандар. Бұл экзогенді PPi-нің қан сарысуындағы базальды деңгейіне дейін жылдам гидролизденуіне байланысты, бұл буындар сияқты басқа жұмсақ тіндерде эктопиялық кальцинацияны болдырмау үшін PPi әсер ету уақытын азайтады. Лмнадағы дұрыс PPi гомеостазын қалпына келтіруG609G/+Жасушадан тыс пирофосфат алмасуына қатысатын ферменттердің фармакологиялық ингибиторларын пайдаланатын тышқандар өмір сүру сапасын да, өмір сүру ұзақтығын да жақсарта алады.
HGPS пациенттері сияқты, LmnaG609G/+ тышқандар ағзаның жасушадан тыс пирофосфатты (PPi) синтездеу қабілетінің бұзылуына байланысты шамадан тыс тамырлы кальцификацияны көрсетеді. Жасушадан тыс PPi деградациясы мен синтезі арасындағы теңгерімсіздік артикулярлық шеміршек пен басқа да жұмсақ тіндердің патологиялық кальцинациясына әкелуі мүмкін болғандықтан, прогерин экспрессиясымен байланысты айналымдағы PPi жүйелі төмендеуі тамырлардың кальцинациясын, сүйек пен буын аномалияларын қоса, бірнеше HGPS клиникалық көріністерін түсіндіруі мүмкін. Экзогенді PPi-мен емдеу қан тамырларының кальцинациясын төмендетті, бірақ Lmna өмір сүру ұзақтығын ұзартпады.G609G/G609G тышқандар. Бұл экзогенді PPi-нің қан сарысуындағы базальды деңгейіне дейін жылдам гидролизденуіне байланысты, бұл буындар сияқты басқа жұмсақ тіндерде эктопиялық кальцинацияны болдырмау үшін PPi әсер ету уақытын азайтады. Лмнадағы дұрыс PPi гомеостазын қалпына келтіруG609G/+Жасушадан тыс пирофосфат алмасуына қатысатын ферменттердің фармакологиялық ингибиторларын пайдаланатын тышқандар өмір сүру сапасын да, өмір сүру ұзақтығын да жақсарта алады.
Рикардо Вилла-Беллоста 2010 жылы Сарагоса университетінде (Испания) PhD дәрежесін алды. Оның докторлық жұмысы тамырлардың кальцинациясындағы фосфатты тасымалдаушылардың рөліне, бүйрек физиологиясына және мышьяктың токсикокинетикасына бағытталған. Жұмысы үшін ол бірнеше марапаттарға ие болды, соның ішінде Төтенше докторлық сыйлығы, Испания корольдік дәрігерлер академиясының сыйлығы және Энрике Корис зерттеу сыйлығы. Ол Атлантадағы (АҚШ) Эмори университетінің Медицина мектебінің зерттеушісі болды, онда ол аорта қабырғасындағы жасушадан тыс пирофосфат (ePPi) метаболизмін зерттеді. 2012 жылы ол Centro Nacional de Investigaciones Cardiovasculares-ке (CNIC, Испания) Хуан де ла Сиерваның докторантурадан кейінгі зерттеушісі ретінде қосылды, ол өз жұмысын атерома бляшкасының кальцинациясында және HGPS тышқандарындағы қан тамырларының кальцинациясында ePPi метаболизміне бағыттайды. 2015 жылы ол гемодиализбен ауыратын науқастардағы фосфат/пирофосфат гомеостазын зерттеу үшін Сара Борреллдің докторантурадан кейінгі зерттеушісі ретінде Fundación Himenez Díaz университетінің денсаулық зерттеу институтына (FIIS-FJD, Испания) көшті. 2015 жылдың қыркүйегінде созылмалы бүйрек ауруы мен қант диабетіндегі қан тамырларының кальцинациясындағы ePPi метаболизмінің рөлін зерттеу үшін FIIS-FJD топ жетекшісі ретінде «I+D+I жас зерттеушілер» стипендиясына ие болды.
 HGPS-тің қоздырғыш мутациясы ламин А-ға әсер етеді. AKTIP, біз жақында сипаттаған ақуыз, теломера мен ДНҚ метаболизміне қатысы бар, жасуша тіршілігіне қажетті ламинмен әрекеттесу факторы болып табылады. Төрт негізгі бақылау бұл жаңа ақуызды HGPS-пен байланыстырады: i) AKTIP бұзылуы жасушалардағы HGPS сипаттамаларын қайталайды; ii) AKTIP бұзылуы тышқандардағы HGPS сипаттамаларын қайталайды; iii) AKTIP ламиндермен әрекеттеседі және iv) AKTIP пациенттен алынған HGPS жасушаларында өзгереді. Біздің зерттеулерімізде біз AKTIP кешені ДНҚ репликативті оқиғаларын тексеру үшін бақылау нүктесі ретінде әрекет етеді деген гипотезаны қоямыз. Біз HGPS-те бұл бақылау нүктесі бұзылады деп күтеміз, бұл өз кезегінде HGPS фенотипіне ықпал етуі мүмкін. Біз AKTIP функциясын in vitro және тышқандарда кеңінен талдауды ұсынамыз. Бұл зерттеу AKTIP арқылы прогерин мен теломера дисфункциясы арасындағы байланыс туралы жаңа түсініктер береді, сонымен қатар прогерияның әлеуетті драйвер механизмі ретінде ДНҚ репликациясының бұзылуының рөлі туралы ақпарат береді деп күтеміз. HGPS этиологиясының детерминанттары мен қозғаушы механизмдері туралы білім әлі толық алынбағанын ескере отырып, AKTIP сияқты жаңа ламиндік өзара әрекеттесетін ойыншылар бойынша зерттеулер HGPS-тің механикалық негіздерін бөлуге және жолды ашуға көмектесетініне сенеміз. жаңа терапиялық стратегияларға.
HGPS-тің қоздырғыш мутациясы ламин А-ға әсер етеді. AKTIP, біз жақында сипаттаған ақуыз, теломера мен ДНҚ метаболизміне қатысы бар, жасуша тіршілігіне қажетті ламинмен әрекеттесу факторы болып табылады. Төрт негізгі бақылау бұл жаңа ақуызды HGPS-пен байланыстырады: i) AKTIP бұзылуы жасушалардағы HGPS сипаттамаларын қайталайды; ii) AKTIP бұзылуы тышқандардағы HGPS сипаттамаларын қайталайды; iii) AKTIP ламиндермен әрекеттеседі және iv) AKTIP пациенттен алынған HGPS жасушаларында өзгереді. Біздің зерттеулерімізде біз AKTIP кешені ДНҚ репликативті оқиғаларын тексеру үшін бақылау нүктесі ретінде әрекет етеді деген гипотезаны қоямыз. Біз HGPS-те бұл бақылау нүктесі бұзылады деп күтеміз, бұл өз кезегінде HGPS фенотипіне ықпал етуі мүмкін. Біз AKTIP функциясын in vitro және тышқандарда кеңінен талдауды ұсынамыз. Бұл зерттеу AKTIP арқылы прогерин мен теломера дисфункциясы арасындағы байланыс туралы жаңа түсініктер береді, сонымен қатар прогерияның әлеуетті драйвер механизмі ретінде ДНҚ репликациясының бұзылуының рөлі туралы ақпарат береді деп күтеміз. HGPS этиологиясының детерминанттары мен қозғаушы механизмдері туралы білім әлі толық алынбағанын ескере отырып, AKTIP сияқты жаңа ламиндік өзара әрекеттесетін ойыншылар бойынша зерттеулер HGPS-тің механикалық негіздерін бөлуге және жолды ашуға көмектесетініне сенеміз. жаңа терапиялық стратегияларға.
Изабелла Саджио Сапиенца университетінде (Рим, Италия) генетика бойынша PhD дәрежесін алды. Ол 1991 жылдан 1994 жылға дейін Молекулярлық биология бойынша Мерк ғылыми-зерттеу институтында (Италия Рим) жұмыс істеді. 1994 жылдан 1997 жылға дейін IGR (Париж Франция) ЕО докторантурасының ғылыми қызметкері болды. 1998 жылы ол Сапиенза университетіне алғаш рет ғылыми қызметкер, содан кейін генетика және гендік терапия кафедрасының доценті ретінде оралды. IS негізгі ғылыми қызығушылықтары теломерлер мен қартаюды зерттеумен қатар гендік терапия болып табылады. IS 2003 жылдан 2011 жылға дейін Сан-Раффаэле ғылыми паркінің мүшесі, 2003 жылдан бастап CNR, 2016 жылдан бастап Ламинопатияларға арналған итальяндық желінің бөлігі болып табылады. IS Италиядағы университетаралық биотехнологиялық желідегі Sapienza өкілі болып табылады, Сапиенцадағы халықаралық қызметті үйлестіреді және қарым-қатынастарды жақсарту үшін 2016 жылы ғылыми журналистика магистрі негізін қалады зерттеушілер мен қоғам арасындағы (www.mastersgp.it). Сайтта АЖ қызметі сипатталған: www.saggiolab.com.
.jpg) Біздің мақсатымыз - жаңа потенциалды прогерия терапевтік агенттерін in vivo сынау. Бұл жоғары бірлескен жоба Том Мистелидің зертханасында бірнеше үміткер емдік агенттердің ашылуына, Карлос Лопес-Отин зертханасында HGPS жануар үлгісін жасауға және Алисия Родригес-Фолгерастың әртүрлі қосылыстарды сынаудағы тәжірибесіне негізделген. in-vivo параметрі.
Біздің мақсатымыз - жаңа потенциалды прогерия терапевтік агенттерін in vivo сынау. Бұл жоғары бірлескен жоба Том Мистелидің зертханасында бірнеше үміткер емдік агенттердің ашылуына, Карлос Лопес-Отин зертханасында HGPS жануар үлгісін жасауға және Алисия Родригес-Фолгерастың әртүрлі қосылыстарды сынаудағы тәжірибесіне негізделген. in-vivo параметрі.
Том Мистели - NIH құрметті тергеушісі және NIH Ұлттық онкологиялық институтының онкологиялық зерттеулер орталығының директоры. Ол тірі жасушалардағы геномдар мен ген экспрессиясын зерттеу үшін бейнелеу тәсілдерін қолданудың пионері болған халықаралық танымал жасуша биологы. Оның зертханасының қызығушылығы 3D геномының ұйымдастырылуы мен қызметінің негізгі принциптерін ашу және бұл білімді қатерлі ісік пен қартаюдың жаңа диагностикалық және терапиялық стратегияларын әзірлеуге қолдану болып табылады. Ол Лондон университетінде (Ұлыбритания) PhD дәрежесін алды және Cold Spring Harbor зертханасында докторантурадан кейінгі білім алды. Оның жұмысы үшін ол көптеген марапаттарға ие болды, соның ішінде Герман Берман сыйлығы, Вильгельм Бернхард медалі, Чарльз университетінің алтын медалі, Флемминг сыйлығы, Джан-Тондури сыйлығы, NIH директорының сыйлығы және NIH Merit Award. Ол көптеген ұлттық және халықаралық агенттіктерде кеңесші қызметін атқарады және бірнеше редакциялық кеңестерде қызмет етеді, соның ішінде Жасуша, ғылым және PLoS биологиясы. Ол Бас редакторы Жасуша биологиясындағы қазіргі пікір.
 Бұл жобада біз зерттеу зертханасында бұрын анықталған хит негізінде Хатчинсон-Гилфорд прогерия синдромын (HGPS немесе прогерия) емдеуге арналған жаңа изопренилцистеинкарбоксилметилтрансфераза (ICMT) тежегіштерін әзірлеуді ұсынамыз. Бұл соққы (UCM-13239) ICMT-ны айтарлықтай тежейді, прогероидты фибробласттарда (LmnaG609G/G609G) прогерин протеинінің қате локализациясын индукциялайды, осы жасушалардың өміршеңдігін арттырады және өңделген жасушаларда өмір сүруге көмектесетін сигналдық жолдарға ықпал етеді. Бұл қосылысты бастапқы нүкте ретінде пайдалана отырып, біздің команда биологиялық белсенділік пен фармакокинетикалық параметрлері бойынша жақсартылған қосылыстар алуға бағытталған дәрілік химия бағдарламасын (қорғасынға соққы және қорғасынды оңтайландыру) жүргізеді. Оңтайлы қосылыстар (қосылыстар) прогерияның in vivo үлгісінде тиімділік үшін бағаланады.
Бұл жобада біз зерттеу зертханасында бұрын анықталған хит негізінде Хатчинсон-Гилфорд прогерия синдромын (HGPS немесе прогерия) емдеуге арналған жаңа изопренилцистеинкарбоксилметилтрансфераза (ICMT) тежегіштерін әзірлеуді ұсынамыз. Бұл соққы (UCM-13239) ICMT-ны айтарлықтай тежейді, прогероидты фибробласттарда (LmnaG609G/G609G) прогерин протеинінің қате локализациясын индукциялайды, осы жасушалардың өміршеңдігін арттырады және өңделген жасушаларда өмір сүруге көмектесетін сигналдық жолдарға ықпал етеді. Бұл қосылысты бастапқы нүкте ретінде пайдалана отырып, біздің команда биологиялық белсенділік пен фармакокинетикалық параметрлері бойынша жақсартылған қосылыстар алуға бағытталған дәрілік химия бағдарламасын (қорғасынға соққы және қорғасынды оңтайландыру) жүргізеді. Оңтайлы қосылыстар (қосылыстар) прогерияның in vivo үлгісінде тиімділік үшін бағаланады.
Сильвия Ортега-Гутьеррес Мадридтегі Комплютенс университетінде докторлық дәрежесін алды, ол дәрілік химия саласында профессор Мария Луз Лопес-Родригестің жетекшілігімен жұмыс істеді. Осыдан кейін ол Фулбрайт стипендиясымен химиялық биология және протеомика саласында жұмыс істеу үшін Скриппс зерттеу институтында (Калифорния, АҚШ) профессор Бен Краватттың зертханасына қосылды. 2008 және 2012 жылдар аралығында ол Комплютенс университетінің органикалық химия кафедрасында Рамон и Кажал стипендиаты болды, ол жерде 2013 жылы доцент дәрежесіне көтерілді. Бұл қазіргі уақытта оның атқаратын лауазымы.
Доктор Ортега-Гутьеррестің қызығушылықтары – дәрілік химия және химиялық биология, атап айтқанда, эндогендік каннабиноидты және лизофосфатид қышқылы жүйелерінің өрістері, жаңа емдік мақсаттарды тексеру және G протеинін зерттеуге арналған химиялық зондтарды әзірлеу. - қосылатын рецепторлар. Оның жұмысы Science, Nature Neuroscience, Angewandte Chemie және Journal of Medicinal Chemistry сияқты беделді журналдарда, сондай-ақ фармацевтика өнеркәсібіне берілген патенттерде жарияланған. 2011 және 2016 жылдары Еуропалық Медициналық химия федерациясының «Академиядағы жас дәрілік химик үшін жүлделі орын» жүлдесін және 2012 жылы Испания Корольдік химия қоғамының «Жас зерттеуші сыйлығын» алды.
 Хатчинсон-Гилфорд прогериялық синдромы (HGPS) сирек кездесетін генетикалық ауру, ол мутация нәтижесінде пайда болады. LMNA атеросклерозға, гипертонияға, жүрек гипертрофиясына және жүрек жеткіліксіздігінен өлімге әкелетін жүрек-қантамыр ауруларын қоса, ерте қартаю ерекшеліктеріне ұқсас ауыр белгілермен сипатталады. Пациенттерде және HGPS тінтуірінің модельдерінде жүргізілген алдыңғы зерттеулер қан тамырларындағы тегіс бұлшықет жасушаларының үдемелі жоғалуын анықтады, бірақ эндотелий жасушаларының функциясы бұзылғанына қарамастан, HGPS-байланысты жүрек-қан тамырлары ауруларының дамуындағы эндотелий жасушаларының рөлі әлі талданған жоқ. қалыпты қартаю кезінде жүрек-қан тамырлары ауруларының негізгі қауіп факторы. Жүрек-қан тамырларының қартаю патологиясының молекулалық негізін зерттеу және қартайған тамыр эндотелийінің HGPS-ке қалай әсер ететінін зерттеу үшін біз HGPS тудыратын тінтуірдің жаңа үлгісін жасадық. LMNA тамырлы эндотелий жасушаларының жүйесінде селективті мутантты ген өнімі. Тышқандарға жүргізген алдын ала талдауларымыз өсудің баяулауын, жүректегі фиброздың жоғарылауын, жүрек гипертрофиясын, гипертрофия маркерлерінің жоғарылауын және HGPS жүрек-қан тамырлары фенотипіне ұқсайтын мутантты тышқандардың мерзімінен бұрын өлуін көрсетті. Бұл жобада біз мутантты молекулалық механизмдерді зерттейміз LMNA гендік өнім қан тамырындағы эндотелий жасушаларына әсер етеді және бұл жүрек жұмысына қалай әсер етеді. Біз мутантты эндотелий жасушалары мен тамырларда бөлінетін про-атерогенді компоненттерді анықтаймыз және бұл жолдың басқа ұлпалар мен жасушаларға қалай әсер ететінін тексереміз. Бұл жоба сонымен қатар қандағы HGPS-байланысты жүрек-қан тамырлары ауруларының ықтимал биомаркерлерін анықтайды. Біздің жоба алғаш рет HGPS-те жүрек-қан тамырлары ауруларының дамуындағы тамырлы эндотелийдің рөлін зерттейді және диагностика мен терапияның ықтимал мақсаттары ретінде жаңа (про-атерогенді) жолдар мен компоненттерді анықтайды.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) сирек кездесетін генетикалық ауру, ол мутация нәтижесінде пайда болады. LMNA атеросклерозға, гипертонияға, жүрек гипертрофиясына және жүрек жеткіліксіздігінен өлімге әкелетін жүрек-қантамыр ауруларын қоса, ерте қартаю ерекшеліктеріне ұқсас ауыр белгілермен сипатталады. Пациенттерде және HGPS тінтуірінің модельдерінде жүргізілген алдыңғы зерттеулер қан тамырларындағы тегіс бұлшықет жасушаларының үдемелі жоғалуын анықтады, бірақ эндотелий жасушаларының функциясы бұзылғанына қарамастан, HGPS-байланысты жүрек-қан тамырлары ауруларының дамуындағы эндотелий жасушаларының рөлі әлі талданған жоқ. қалыпты қартаю кезінде жүрек-қан тамырлары ауруларының негізгі қауіп факторы. Жүрек-қан тамырларының қартаю патологиясының молекулалық негізін зерттеу және қартайған тамыр эндотелийінің HGPS-ке қалай әсер ететінін зерттеу үшін біз HGPS тудыратын тінтуірдің жаңа үлгісін жасадық. LMNA тамырлы эндотелий жасушаларының жүйесінде селективті мутантты ген өнімі. Тышқандарға жүргізген алдын ала талдауларымыз өсудің баяулауын, жүректегі фиброздың жоғарылауын, жүрек гипертрофиясын, гипертрофия маркерлерінің жоғарылауын және HGPS жүрек-қан тамырлары фенотипіне ұқсайтын мутантты тышқандардың мерзімінен бұрын өлуін көрсетті. Бұл жобада біз мутантты молекулалық механизмдерді зерттейміз LMNA гендік өнім қан тамырындағы эндотелий жасушаларына әсер етеді және бұл жүрек жұмысына қалай әсер етеді. Біз мутантты эндотелий жасушалары мен тамырларда бөлінетін про-атерогенді компоненттерді анықтаймыз және бұл жолдың басқа ұлпалар мен жасушаларға қалай әсер ететінін тексереміз. Бұл жоба сонымен қатар қандағы HGPS-байланысты жүрек-қан тамырлары ауруларының ықтимал биомаркерлерін анықтайды. Біздің жоба алғаш рет HGPS-те жүрек-қан тамырлары ауруларының дамуындағы тамырлы эндотелийдің рөлін зерттейді және диагностика мен терапияның ықтимал мақсаттары ретінде жаңа (про-атерогенді) жолдар мен компоненттерді анықтайды.
Роланд Фойснер – Вена медициналық университетінің биохимия университетінің профессоры және Макс Перутц зертханасы директорының орынбасары. Ол 1984 жылы Вена техникалық университетінде биотехнология бойынша PhD (доктор техника) дәрежесін алды, Вена университетінде ассистент, содан кейін доцент болды және Медицина университетінің медициналық биохимия кафедрасының толық профессоры болып тағайындалды. 2002 ж. Вена. 1991-1992 жж. Ла Джолладағы Скриппс ғылыми-зерттеу институты, Калифорния, АҚШ.
Роланд Фойснер жаңа терапиялық тәсілдерді әзірлеу үшін ламинозды аурулардың молекулалық механизмдерін талдауға бағытталған клиникалық және іргелі зерттеушілердің еуропалық желілік жобасы EURO-Laminopathies ғылыми үйлестірушісі болды. Ол Journal Nucleus бас редакторы, бірнеше Cell Biology журналдарының редакциялық кеңесінде, ЕО жобаларының ғылыми-консультативтік кеңесінде және бірнеше халықаралық қаржыландыру ұйымдарының шолу комиссияларында қызмет етеді. Ол 2007 жылға дейін Халықаралық Вена биоцентрінің PhD бағдарламасының аспирантурасының деканы болды және көптеген ұлттық және халықаралық диссертациялық комиссияларда қызмет етті.
Роланд Фойснер зертханасындағы зерттеулер ядролық және хроматиндік ұйымдағы ламиндер мен ламинді байланыстыратын ақуыздардың динамикасы мен функцияларына, гендердің экспрессиясын және сигнализациясын реттеуге және бұлшықет дистрофиясынан ерте қартаюға дейінгі генетикалық ауруларға бағытталған. Ол көптеген маңызды рецензияланған мақалаларды, шақырылған шолулар мен кітап тарауларын жариялады және ұлттық және халықаралық кездесулерде көптеген шақырылған семинарлар берді.
 Жүрек-қантамыр жүйесіндегі өзгерістер Прогериямен ауыратындар арасында өлімнің негізгі себебі болып табылады. Доктор Белмонте зертханасы Прогериямен ауыратын науқастардан алынған индукцияланған плюрипотентті дің жасушаларын (iPSC) пайдалану негізінде Прогерияны зерттеуге арналған жаңа үлгілерді әзірледі. Оның зертханасы қазір адам мен тышқандардағы Прогерияның жүрек-қан тамырлары өзгерістерін жақсартатын жаңа препараттарды табу үшін осы үлгілерден жасалған тамыр жасушаларын пайдалануда. Бұл ашылулар Прогерия науқастарын емдеудің жаңа әдістерін дамытуға әкелуі мүмкін.
Жүрек-қантамыр жүйесіндегі өзгерістер Прогериямен ауыратындар арасында өлімнің негізгі себебі болып табылады. Доктор Белмонте зертханасы Прогериямен ауыратын науқастардан алынған индукцияланған плюрипотентті дің жасушаларын (iPSC) пайдалану негізінде Прогерияны зерттеуге арналған жаңа үлгілерді әзірледі. Оның зертханасы қазір адам мен тышқандардағы Прогерияның жүрек-қан тамырлары өзгерістерін жақсартатын жаңа препараттарды табу үшін осы үлгілерден жасалған тамыр жасушаларын пайдалануда. Бұл ашылулар Прогерия науқастарын емдеудің жаңа әдістерін дамытуға әкелуі мүмкін.
Доктор Хуан Карлос Белмонте Изписуа, гендік экспрессия зертханасының профессоры. Салк биологиялық зерттеулер институты, Ла Джолла, Калифорния, АҚШ. Ол бұрынғы директор және оны құруға көмектесті Барселонадағы регенеративті медицина орталығы. Оның Ph.D. Биохимия және фармакология бойынша Болонья университетінен, Италиядан және Валенсия университетінен, Испаниядан. Ол Гейдельберг, Германия және UCLA, АҚШ, Марбург университетінің Еуропалық молекулярлық биология зертханасының (EMBL) докторантурасының ғылыми қызметкері.
 Жақында басқалардың зерттеуі [Gabriel et al., 2015, Қартаю жасушасы 14(1):78-91] изотиоцианат сульфорафан (брокколиден алынған фитохимиялық зат) Прогериясы бар балалардан алынған өсірілген жасушалардың өсу қарқынын арттырғанын және синдроммен байланысты әртүрлі биомаркерлерді арттыратынын көрсетті. Жеуге жарамды өсімдіктерден алынған изоцианаттармен жұмысымыз осы жүзден астам тығыз байланысты қосылыстардың кейбірінің емдік терезелері (тиімді және улы концентрация арасындағы диапазон) болуы керек және сульфорафанға қарағанда тиімді концентрациялары төмен болуы керек деп болжайды. Біз бұл гипотезаны тексереміз.
Жақында басқалардың зерттеуі [Gabriel et al., 2015, Қартаю жасушасы 14(1):78-91] изотиоцианат сульфорафан (брокколиден алынған фитохимиялық зат) Прогериясы бар балалардан алынған өсірілген жасушалардың өсу қарқынын арттырғанын және синдроммен байланысты әртүрлі биомаркерлерді арттыратынын көрсетті. Жеуге жарамды өсімдіктерден алынған изоцианаттармен жұмысымыз осы жүзден астам тығыз байланысты қосылыстардың кейбірінің емдік терезелері (тиімді және улы концентрация арасындағы диапазон) болуы керек және сульфорафанға қарағанда тиімді концентрациялары төмен болуы керек деп болжайды. Біз бұл гипотезаны тексереміз.
.jpg) Жақында біз химиялық кітапхана скринингі арқылы прогерин мен Lamin A/C арасындағы өзара әрекеттесуді блоктайтын жаңа химиялық заттарды таптық. Прогерин өндіретін тінтуір үлгісінде (LmnaG609G/G609G), біздің химиялық (JH4) өмір сүру ұзақтығын ұзарта алады, сондай-ақ қартаю фенотиптерін жақсарта алады, соның ішінде дене салмағының артуы, бұлшықет күші мен мүшелердің көлемін арттырады. JH4-тің айқын әсеріне қарамастан Lmnaмасса/G609Gтышқандар, ол тек 4 апта ұзарта алады LmnaG609G/G609G тышқандардың өмір сүру ұзақтығы, бұл JH4 әсерінің қазіргі кезеңде прогерия синдромы үшін емдік препарат ретінде қолдану үшін жеткіліксіз екенін көрсетеді. Сонымен қатар, JH4 әсерін жақсарту қажет. Ол үшін біз JH4 әсерін жақсарту үшін бірнеше сынақтарды өткіземіз. Біріншіден, біз химиялық заттардың гидрофильді түрін өзгертеміз. Шын мәнінде, JH4 өте гидрофобты болып табылады, бұл дозаны арттыра алмайтын себептердің бірі. Осыған байланысты біз JH4-тің ұқсас жасушалық әсері бар гидрофильді қосылысты (JH010) алдық. Шынында да, біздің соңғы нәтиже JH4-тің (10 мг/кг-дан 20 мг/кг-ға дейін) ұлғаюы өмір сүру ұзақтығын 16 аптадан (тасымалдаушымен өңделген) 24 аптаға дейін ұзартуы мүмкін екенін көрсетті (шын мәнінде, 20 мг/кг инъекцияланған тышқандар әлі де болды) тірі). Бұл химиялық затты жақсарту үшін біз JH010 туындыларын жасап, биологиялық әсерін тексердік. Екіншіден, біз JH010-ды бүкіл денеге тиімдірек жеткізетін нанобөлшектерді жасаймыз. Негізі бұл жұмыс басталып та кетті. Екі әдіс арқылы біз JH4-ке қатысты жақсартылған химиялық заттарды аламыз және оларды сынаймыз LmnaG609G/G609G тінтуір үлгісі (өмір сүру ұзақтығы, гистологиялық талдау, уыттылық, фармакодинамика, сонымен қатар фармако-кинетика). Осы зерттеулерден біз HGPS балалары сияқты тінтуір үлгісінде HGPS емдеудің ең жақсы әдісін ұсынғымыз келеді.
Жақында біз химиялық кітапхана скринингі арқылы прогерин мен Lamin A/C арасындағы өзара әрекеттесуді блоктайтын жаңа химиялық заттарды таптық. Прогерин өндіретін тінтуір үлгісінде (LmnaG609G/G609G), біздің химиялық (JH4) өмір сүру ұзақтығын ұзарта алады, сондай-ақ қартаю фенотиптерін жақсарта алады, соның ішінде дене салмағының артуы, бұлшықет күші мен мүшелердің көлемін арттырады. JH4-тің айқын әсеріне қарамастан Lmnaмасса/G609Gтышқандар, ол тек 4 апта ұзарта алады LmnaG609G/G609G тышқандардың өмір сүру ұзақтығы, бұл JH4 әсерінің қазіргі кезеңде прогерия синдромы үшін емдік препарат ретінде қолдану үшін жеткіліксіз екенін көрсетеді. Сонымен қатар, JH4 әсерін жақсарту қажет. Ол үшін біз JH4 әсерін жақсарту үшін бірнеше сынақтарды өткіземіз. Біріншіден, біз химиялық заттардың гидрофильді түрін өзгертеміз. Шын мәнінде, JH4 өте гидрофобты болып табылады, бұл дозаны арттыра алмайтын себептердің бірі. Осыған байланысты біз JH4-тің ұқсас жасушалық әсері бар гидрофильді қосылысты (JH010) алдық. Шынында да, біздің соңғы нәтиже JH4-тің (10 мг/кг-дан 20 мг/кг-ға дейін) ұлғаюы өмір сүру ұзақтығын 16 аптадан (тасымалдаушымен өңделген) 24 аптаға дейін ұзартуы мүмкін екенін көрсетті (шын мәнінде, 20 мг/кг инъекцияланған тышқандар әлі де болды) тірі). Бұл химиялық затты жақсарту үшін біз JH010 туындыларын жасап, биологиялық әсерін тексердік. Екіншіден, біз JH010-ды бүкіл денеге тиімдірек жеткізетін нанобөлшектерді жасаймыз. Негізі бұл жұмыс басталып та кетті. Екі әдіс арқылы біз JH4-ке қатысты жақсартылған химиялық заттарды аламыз және оларды сынаймыз LmnaG609G/G609G тінтуір үлгісі (өмір сүру ұзақтығы, гистологиялық талдау, уыттылық, фармакодинамика, сонымен қатар фармако-кинетика). Осы зерттеулерден біз HGPS балалары сияқты тінтуір үлгісінде HGPS емдеудің ең жақсы әдісін ұсынғымыз келеді.
Доктор Пак Корея университетінде қатерлі ісік биологиясы бойынша PhD дәрежесін алды. Ол докторлықтан кейінгі зерттеулерін Корея Ұлттық денсаулық институтында (KNIH) және Сеул ұлттық университетінде жүргізді. 2006 жылдан бастап Пусан ұлттық университетінде жұмыс істейді. Қазір ол молекулалық биология кафедрасының меңгерушісі. Оның зерттеулері ауруға тән сигналдық желіні (рак, HGPS, Вернер синдромы) анықтауға және есірткіге үміткерлер үшін ауруға байланысты ақуыз-белоктың өзара әрекеттесуін блоктай алатын жаңа химиялық заттарды табуға бағытталған.
 Прогериясы бар балаларда қан тамырлары өте тез қартаяды. Бұл инфаркт пен инсультке әкелетін тамырлы ауруларды тудырады. Біз бұл балалардың қан тамырларының қартаюын қалпына келтіретін терапияны әзірлеуді көздеп отырмыз. Бұрын біз қартайған адам жасушаларын теломеразаны кодтайтын модификацияланған хабарлы РНҚ (ммРНҚ) көмегімен емдеу арқылы жасартуға болатынын көрсеттік. Теломераза – теломерлерді хромосомаларға тарататын ақуыз.
Прогериясы бар балаларда қан тамырлары өте тез қартаяды. Бұл инфаркт пен инсультке әкелетін тамырлы ауруларды тудырады. Біз бұл балалардың қан тамырларының қартаюын қалпына келтіретін терапияны әзірлеуді көздеп отырмыз. Бұрын біз қартайған адам жасушаларын теломеразаны кодтайтын модификацияланған хабарлы РНҚ (ммРНҚ) көмегімен емдеу арқылы жасартуға болатынын көрсеттік. Теломераза – теломерлерді хромосомаларға тарататын ақуыз.
Теломерлер аяқ бауының ұшы тәрізді; олар хромосоманы бірге ұстайды, ал теломерлер хромосомалардың қалыпты жұмыс істеуі үшін қажет. Жасушалар қартайған сайын теломерлер қысқарады және белгілі бір уақытта хромосома дұрыс жұмыс істемейді. Бұл кезде жасуша қартаяды және одан әрі көбейе алмайды. Теломерлер – біздің биологиялық сағатымыз. Прогериясы бар балаларда теломерлер тезірек қысқарады. Біз теломерлерді ұзартуға, қартаю процесін кері қайтаруға және тамыр жасушаларын жасартуға болатын-болмайтынымызды білу үшін терапияны Progeria балаларының жасушаларында сынап көргіміз келеді. Егер бұл әдіс нәтиже берсе, біз осы балалардағы клиникалық сынақтарға бағытталған терапияны дамытқымыз келеді.
Доктор Джон П.Кук жүрек-қан тамырлары медицинасы бойынша білім алып, Майо клиникасында физиология бойынша PhD дәрежесін алды. Ол Гарвард медициналық мектебіне медицина кафедрасының ассистенті ретінде қабылданды. 1990 жылы ол Стэнфорд университетіне тамыр биологиясы және медицина саласындағы бағдарламаны басқару үшін жұмысқа қабылданды және Стэнфорд университетінің Медицина мектебінің жүрек-қан тамырлары медицинасы бөлімінің профессоры және Хьюстон әдіскеріне жұмысқа қабылданғанға дейін Стэнфорд жүрек-қан тамырлары институтының директорының орынбасары болып тағайындалды. 2013 жылы.
Доктор Кук 20 000-нан астам дәйексөздермен тамыр медицинасы мен биология саласында 500-ден астам ғылыми мақалаларды, позициялық мақалаларды, шолуларды, кітап тарауларын және патенттерді жариялады; h индексі = 76 (ISI Web of Knowledge, 6-2-13). Ол жүрек-қан тамырлары ауруларымен айналысатын ұлттық және халықаралық комитеттерде, соның ішінде Америка жүрек қауымдастығында, Америка кардиология колледжінде, тамырлы медицина қоғамында және Ұлттық жүрек, өкпе және қан институтында қызмет етеді. Ол қан тамырлары медицинасы қоғамының президенті, американдық тамырлық медицина кеңесінің директоры және қан тамырлары медицинасының редакторы болып қызмет етті.
Доктор Куктың трансляциялық зерттеу бағдарламасы тамырларды қалпына келтіруге бағытталған. Бағдарлама Ұлттық денсаулық институттары, Америка жүрек қауымдастығы және саланың гранттары есебінен қаржыландырылады.
Доктор Куктың зерттеу бағдарламасының басты мақсаты шағын молекулаларды немесе дің жасушаларын емдеуді қолдана отырып, вазодиляция және ангиогенез сияқты эндотелий функцияларын қалпына келтіру немесе ынталандыру болып табылады. Трансляциялық эндотелий биологиясының 25 жылында ол алғаш рет эндотелийден алынған азот оксидінің антиатерогендік әсерін сипаттады және сипаттады; NO синтаза ингибиторының ADMA антиангиогендік әсері; эндотелиальды никотиндік ацетилхолиндік рецепторлар арқылы жүзеге асырылатын ангиогендік жол; патологиялық ангиогенез жағдайындағы осы жолдың рөлі; және қазір II фазадағы клиникалық сынақтардағы жолдың антагонистін жасады. Оның клиникалық зерттеу тобы перифериялық артерия ауруларын емдеуде ангиогендік агенттер мен ересек дің жасушаларын қолдануды зерттеді. Жақында ол адамның iPSC-інен алынған эндотелий жасушаларын жасап, сипаттады және олардың ангиогенездегі және қан тамырларының регенерациясындағы рөлін зерттеді. Зертханадан алынған соңғы түсініктер тамыр аурулары үшін плюрипотенттілікке және терапевтік трансдифференциацияға ядролық қайта бағдарламалаудағы туа біткен иммундық сигнализацияның рөлін түсіндірді.
.jpg) Доктор Коллинз іргелі зерттеулерден клиникалық зерттеулерге дейінгі биомедициналық зерттеулердің әлемдегі ең ірі қолдаушысының жұмысын қадағалайды. Доктор Коллинз және оның командасы The Progeria Research Foundation-пен бірге 2003 жылы HGPS-тің генетикалық себебін ашты және осы жұмысқа он екі жылдан астам қаржы жұмсағандықтан, олардың мақсаты қалады: патогенезді түсіну және HGPS емдеу әдістерін іздеу. Ағымдағы зерттеулер әлеуетті терапиялық тәсілдерге, соның ішінде РНҚ негізіндегі әдістерге және жасушалық және HGPS тінтуірінің үлгілерін пайдалана отырып, рапамицин мен оның аналогтарын қолдануға бағытталған.
Доктор Коллинз іргелі зерттеулерден клиникалық зерттеулерге дейінгі биомедициналық зерттеулердің әлемдегі ең ірі қолдаушысының жұмысын қадағалайды. Доктор Коллинз және оның командасы The Progeria Research Foundation-пен бірге 2003 жылы HGPS-тің генетикалық себебін ашты және осы жұмысқа он екі жылдан астам қаржы жұмсағандықтан, олардың мақсаты қалады: патогенезді түсіну және HGPS емдеу әдістерін іздеу. Ағымдағы зерттеулер әлеуетті терапиялық тәсілдерге, соның ішінде РНҚ негізіндегі әдістерге және жасушалық және HGPS тінтуірінің үлгілерін пайдалана отырып, рапамицин мен оның аналогтарын қолдануға бағытталған.
Фрэнсис С. Коллинз, MD, Ph.D. Ұлттық денсаулық институтының (NIH) директоры. Бұл рөлде ол іргелі зерттеулерден клиникалық зерттеулерге дейінгі спектрді қамтитын әлемдегі биомедициналық зерттеулердің ең үлкен қолдаушысының жұмысын қадағалайды.
Доктор Коллинз – ауру гендерінің маңызды ашылымдарымен және 2003 жылдың сәуірінде адам ДНҚ нұсқаулығының аяқталған тізбегінің аяқталуымен аяқталған «Адам геномы» халықаралық жобасындағы жетекшілігімен танымал дәрігер-генетик. Ол 1993-2008 жылдар аралығында NIH жанындағы Адам геномын зерттеу ұлттық институтының директоры қызметін атқарған.
Доктор Коллинздің жеке зерттеу зертханасы муковисцидозға, нейрофиброматозға, Хантингтон ауруына, отбасылық эндокриндік қатерлі ісік синдромына және соңғы уақытта 2 типті қант диабетіне және Хатчинсон ауруын тудыратын гендерге жауапты бірқатар маңызды гендерді тапты. Гилфорд прогерия синдромы, ерте қартаюды тудыратын сирек жағдай.
Доктор Коллинз Вирджиния университетінде химия бойынша бакалавр дәрежесін алды, Ph.D. Йель университетінің физикалық химия бойынша және Чапел-Хиллдегі Солтүстік Каролина университетінің үздік докторы. 1993 жылы NIH-ке келгенге дейін ол Мичиган университетінің факультетінде тоғыз жыл жұмыс істеді, онда Ховард Хьюз медициналық институтының тергеушісі болды. Ол Медицина институтының және Ұлттық ғылым академиясының сайланған мүшесі. Доктор Коллинз 2007 жылы қарашада Президенттің Бостандық медалімен және 2009 жылы Ұлттық ғылым медалімен марапатталды.
 Хатчинсон-Гилфорд прогерия синдромы (HGPS) – тез қартаюмен сипатталатын сирек кездесетін өлімге әкелетін генетикалық ауру. Адамның HGPS фибробласттарын немесе Lmna жоқ тышқандарды (HGPS тінтуірінің үлгісі) mTOR (механикалық мақсатты Рапамицин) протеинкиназасының ингибиторы рапамицинмен емдеу жасушалық деңгейде HGPS фенотиптерін кері қайтарады және организм деңгейінде өмір сүру ұзақтығы мен денсаулығын жақсартады. . Дегенмен, рапамициннің адамдарда ауыр жанама әсерлері бар, соның ішінде иммуносупрессия және диабетогендік метаболикалық әсерлер, бұл оның HGPS пациенттері үшін ұзақ мерзімді қолданылуына кедергі келтіруі мүмкін. mTOR протеинкиназасы екі түрлі кешенде кездеседі және доктор Ламмингтің зерттеу тобының жұмысы және көптеген басқа зертханалардың жұмысы рапамициннің артықшылықтарының көпшілігі mTOR кешені 1 (mTORC1) басылуынан алынғанын көрсетеді. жанама әсерлер mTOR кешені 2 (mTORC2) «мақсаттан тыс» тежелуіне байланысты.
Хатчинсон-Гилфорд прогерия синдромы (HGPS) – тез қартаюмен сипатталатын сирек кездесетін өлімге әкелетін генетикалық ауру. Адамның HGPS фибробласттарын немесе Lmna жоқ тышқандарды (HGPS тінтуірінің үлгісі) mTOR (механикалық мақсатты Рапамицин) протеинкиназасының ингибиторы рапамицинмен емдеу жасушалық деңгейде HGPS фенотиптерін кері қайтарады және организм деңгейінде өмір сүру ұзақтығы мен денсаулығын жақсартады. . Дегенмен, рапамициннің адамдарда ауыр жанама әсерлері бар, соның ішінде иммуносупрессия және диабетогендік метаболикалық әсерлер, бұл оның HGPS пациенттері үшін ұзақ мерзімді қолданылуына кедергі келтіруі мүмкін. mTOR протеинкиназасы екі түрлі кешенде кездеседі және доктор Ламмингтің зерттеу тобының жұмысы және көптеген басқа зертханалардың жұмысы рапамициннің артықшылықтарының көпшілігі mTOR кешені 1 (mTORC1) басылуынан алынғанын көрсетеді. жанама әсерлер mTOR кешені 2 (mTORC2) «мақсаттан тыс» тежелуіне байланысты.
Рапамицин in vivo mTOR кешендерінің екеуін тежегенімен, mTORC1 және mTORC2 қоршаған ортаның және қоректік заттардың әртүрлі белгілеріне табиғи түрде жауап береді. mTORC1 аминқышқылдарымен тікелей ынталандырылады, ал mTORC2 негізінен инсулинмен және өсу факторы сигналымен реттеледі. Доктор Ламмингтің зерттеу тобы төмен ақуызды диета mTORC1-ді айтарлықтай төмендететінін, бірақ mTORC2 емес, тінтуірдің тіндерінде сигнал беретінін анықтады. Бұл төмен ақуызды диета mTORC1 белсенділігін тежеу және HGPS пациенттеріне терапевтік пайданы қамтамасыз ету үшін салыстырмалы түрде қарапайым, жанама әсерлері төмен әдіс болуы мүмкін деген қызықты мүмкіндікті арттырады. Бұл зерттеуде олар in vivo mTORC1 сигналын тежейтін диетаны анықтайды және бұл диетаның HGPS-тің прогерин-экспрессиялық тінтуір үлгісіндегі in vivo және адам HGPS пациентінің жасушалық желілерінде in vitro HGPS патологиясын құтқару мүмкіндігін анықтайды.
Дадли Ламминг 2008 жылы Гарвард университетінде эксперименталды патология бойынша PhD дәрежесін доктор Дэвид Синклэрдің зертханасында алды, содан кейін Кембридждегі Уайтхед биомедициналық зерттеулер институтында доктор Дэвид Сабатинидің зертханасында докторантурадан кейінгі оқуды аяқтады. Доктор Ламмингтің зерттеулері ішінара NIH/NIA K99/R00 Pathway to Independence Award сыйлығымен, сондай-ақ Американдық Қартаюды зерттеу федерациясының Кіші Факультет зерттеу сыйлығымен қолдау көрсетеді. Оның Висконсин университетіндегі зертханасы денсаулықты нығайту және қалыпты қартаюды, сондай-ақ Хатчинсон-Гилфорд Прогерия синдромы сияқты ерте қартаю ауруларын кешіктіру үшін қоректік заттарға жауап беретін сигналдық жолдарды қалай пайдалануға болатындығын білуге бағытталған.
.jpg) Хатчинсон-Гилфорд прогериялық синдромы (HGPS) өте сирек кездесетін генетикалық ауру, ерте және жедел қартаюмен және мезгілсіз өліммен сипатталады. Бұл өлімге әкелетін ауру үшін жаңа емдік қосылыстардың ашылуы өте маңызды. Эндогендік молекула нейропептид Y (NPY) HGPS әсерінен әртүрлі органдар мен жасушаларда локализацияланған NPY рецепторларын белсендіреді. Біздің алдын ала деректеріміз бен соңғы жарияланымдарымыз нейропептид Y (NPY) жүйесі HGPS үшін болжамды емдік мақсат болуы мүмкін екенін көрсетеді.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) өте сирек кездесетін генетикалық ауру, ерте және жедел қартаюмен және мезгілсіз өліммен сипатталады. Бұл өлімге әкелетін ауру үшін жаңа емдік қосылыстардың ашылуы өте маңызды. Эндогендік молекула нейропептид Y (NPY) HGPS әсерінен әртүрлі органдар мен жасушаларда локализацияланған NPY рецепторларын белсендіреді. Біздің алдын ала деректеріміз бен соңғы жарияланымдарымыз нейропептид Y (NPY) жүйесі HGPS үшін болжамды емдік мақсат болуы мүмкін екенін көрсетеді.
Бұл зерттеуде біз NPY және/немесе NPY рецепторларының активаторларының екі HGPS үлгісінде қартаю фенотипін құтқарудағы пайдалы әсерін зерттейтін боламыз: HGPS жасуша негізіндегі және тінтуір үлгісінде. Осы жоба арқылы біз NPY жүйесін белсендіру HGPS терапевтикасы немесе котерапевтикасы үшін инновациялық стратегия екенін көрсетеміз деп күтеміз.
Клаудия Кавадас Коимбра университетінің фармацевтика факультетінің фармакология ғылымдарының кандидаты дәрежесіне ие. Ол Коимбра университетінің CNC – нейробиология және жасушалық биология орталығында «Нейроэндокринология және қартаю тобы» тобының жетекшісі. Клаудиа Кавадас 50 жарияланымның бірлескен авторы және 1998 жылдан бері нейропептид Y (NPY) жүйесін зерттейді. Ол Португалия фармакология қоғамының вице-президенті (2013 жылдан бастап); Клаудия Кавадас Коимбра университетінің Пәнаралық зерттеулер институтының бұрынғы директоры (2010-2012) болды.
 Хатчинсон-Гилфорд прогериялық синдромы (HGPS), өлімге әкелетін генетикалық ауру, ерте жедел қартаюмен сипатталады. HGPS көбінесе ламиндік A/C генінің (LMNA) ішіндегі прогерин деп аталатын анормальды ламин А протеинін шығаратын жаңа нүктелік мутациядан (G608G) туындайды. Прогериннің жинақталуы ядролық ауытқуларды тудырады және жасушалық циклдің тоқтатылуы, сайып келгенде, жасушалық қартаюға әкеледі, сондықтан HGPS прогрессиясының негізінде жатқан механизмдердің бірі болып табылады. Рапамициннің аутофагияны ынталандыру арқылы прогериннің клиренсіне ықпал ететіні және HGPS үлгілеріне пайдалы әсер ететіні көрсетілген. Рапамициннің белгілі жағымсыз әсерлері болғандықтан, HGPS пациенттерін созылмалы емдеу үшін басқа пайдалы әсерлері бар аутофагияның қауіпсіз стимуляторларын анықтау өте маңызды.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS), өлімге әкелетін генетикалық ауру, ерте жедел қартаюмен сипатталады. HGPS көбінесе ламиндік A/C генінің (LMNA) ішіндегі прогерин деп аталатын анормальды ламин А протеинін шығаратын жаңа нүктелік мутациядан (G608G) туындайды. Прогериннің жинақталуы ядролық ауытқуларды тудырады және жасушалық циклдің тоқтатылуы, сайып келгенде, жасушалық қартаюға әкеледі, сондықтан HGPS прогрессиясының негізінде жатқан механизмдердің бірі болып табылады. Рапамициннің аутофагияны ынталандыру арқылы прогериннің клиренсіне ықпал ететіні және HGPS үлгілеріне пайдалы әсер ететіні көрсетілген. Рапамициннің белгілі жағымсыз әсерлері болғандықтан, HGPS пациенттерін созылмалы емдеу үшін басқа пайдалы әсерлері бар аутофагияның қауіпсіз стимуляторларын анықтау өте маңызды.
Грелин айналымдағы пептидті гормон болып табылады және өсу гормонының секреторлық рецепторының эндогендік лиганды болып табылады, сондықтан өсу гормонын шығаратын белсенділікке ие. Өзінің белгілі орексигендік әсерінен басқа, грелин жүрек-қан тамырларын қорғау, атеросклерозды реттеу, ишемия/реперфузиялық жарақаттан қорғау, сондай-ақ миокард инфарктісі мен жүрек жеткіліксіздігінің болжамын жақсарту сияқты әртүрлі органдар мен жүйелерде пайдалы рөлдерге ие. Сонымен қатар, грелин мен грелин аналогтары созылмалы жүрек жеткіліксіздігі кезіндегі кахексия, егде жастағы адамдарда әлсіздік және өсу гормонының тапшылығына байланысты бұзылулар сияқты ауруларды емдеу үшін кейбір клиникалық сынақтарда сыналған, сондықтан қауіпсіз терапиялық стратегия ретінде қарастырылуы мүмкін. Сонымен қатар, біздің соңғы деректеріміз грелиннің аутофагияны ынталандыратынын және HGPS жасушаларында прогерин клиренсіне ықпал ететінін көрсетеді. Бұл зерттеуде біз грелин мен грелин рецепторларының агонистерінің HGPS емі ретінде әлеуетін зерттейміз. Осы мақсатта HGPS тінтуірінің үлгісі LmnaG609G/G609G тышқандарын пайдалана отырып, грелин/грелин рецепторларының агонистерін шеткергі енгізу HGPS фенотипін жақсартуға және өмір сүру ұзақтығын ұзартуға болатынын бағалаймыз. Сонымен қатар, біз грелиннің HGPS қартайған жасушалық фенотипіне кері әсер ететінін анықтаймыз, бұл аутофагия арқылы прогерин клиренсіне ықпал етеді, бұл жасушалар жасуша гомеостазын сақтау үшін қажет емес немесе жұмыс істемейтін ақуыздар мен органеллаларды тазартады.
Селия Авелейра 2010 жылы Коимбра университетінде, Португалияда биомедициналық ғылымдар бойынша PhD дәрежесін алды. Ол өзінің диссертациясын Коимбра университетінің медицина факультетінің Офтальмология және көру ғылымдары орталығында және Португалиядағы жасушалық және молекулалық физиология департаментінде, Пенн қаласында орындады. Мемлекеттік медицина колледжі, Пенн Стейт университеті, Херши, Пенсильвания, АҚШ. Осыдан кейін ол докторантурадан кейінгі зерттеулерін жүргізу үшін Португалиядағы Коимбра университетінің Нейрология және жасушалық биология орталығындағы Клаудиа Кавадастың зерттеу тобына қосылды. Оған қартаюды азайту және жасқа байланысты ауруларды жақсарту үшін калориялық шектеудің миметикасы ретінде нейропептид Y (NPY) потенциалды рөлін зерттеу үшін FCT Post-Doc стипендиясы берілді. 2013 жылы ол CNC-де шақырылған ғалым-зерттеуші ретінде қазіргі лауазымын қабылдады. Оның зерттеу орталықтары аутофагия және тіндерді қалпына келтіру сияқты гомеостатикалық механизмдерге ерекше назар аудара отырып, Хатчинсон-Гилфорд прогерия синдромы (HGPS) сияқты қалыпты және ерте қартаю ауруларының қартаю процесін кешіктіруге бағытталған терапевтік мақсат ретінде калорияларды шектеу миметикасының рөлін зерттейді. дің/прогениторлық жасушалардың сыйымдылығы.
 Хатчинсон-Гилфорд прогериялық синдромы (HGPS) - ерте қартаюмен және өліммен сипатталатын сирек ауру (орташа жас 13,4 жас). Әзірге HGPS-тің ең көп тараған себебі - прогериннің жинақталуына әкелетін ламин А ақуызын кодтайтын геннің мутациясы, құрамында фарнесиляция деп аталатын химиялық модификациясы бар және патологияны тудырады деп есептелетін А ламинінің өзгертілген түрі. . Сондықтан ғалымдар бұл модификацияны болдырмайтын терапияны жасауға тырысуда. Дегенмен, осы эксперименттік терапиялардың нәтижелерін талдау қиын, өйткені бүгінгі күні жануарлар үлгілерінде немесе HGPS пациенттерінде фарнецирленген прогерин деңгейін өлшеудің сенімді әдістері жоқ. CNIC зерттеушілері модификацияланған ақуыздың деңгейін тінтуірден, сондай-ақ HGPS-тен масс-спектрометрия деп аталатын әдіс арқылы өсірілген фибробласттарда (теріден алынған жасушалар препараты) сенімді түрде анықтауға болатынын көрсетті. Ағымдағы жобада бұл зерттеушілер HGPS пациенттерінің қан үлгілерінде тікелей фарнецирленген прогериннің мөлшерін анықтауға мүмкіндік беретін әдістемені жақсартуға тырысуда. Сәтті болған жағдайда бұл әдіс ғалымдарға адамдардағы эксперименттік емдеудің тиімділігін бағалау және осы аурудың дамуы мен ауырлығын бақылау үшін баға жетпес құрал береді.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) - ерте қартаюмен және өліммен сипатталатын сирек ауру (орташа жас 13,4 жас). Әзірге HGPS-тің ең көп тараған себебі - прогериннің жинақталуына әкелетін ламин А ақуызын кодтайтын геннің мутациясы, құрамында фарнесиляция деп аталатын химиялық модификациясы бар және патологияны тудырады деп есептелетін А ламинінің өзгертілген түрі. . Сондықтан ғалымдар бұл модификацияны болдырмайтын терапияны жасауға тырысуда. Дегенмен, осы эксперименттік терапиялардың нәтижелерін талдау қиын, өйткені бүгінгі күні жануарлар үлгілерінде немесе HGPS пациенттерінде фарнецирленген прогерин деңгейін өлшеудің сенімді әдістері жоқ. CNIC зерттеушілері модификацияланған ақуыздың деңгейін тінтуірден, сондай-ақ HGPS-тен масс-спектрометрия деп аталатын әдіс арқылы өсірілген фибробласттарда (теріден алынған жасушалар препараты) сенімді түрде анықтауға болатынын көрсетті. Ағымдағы жобада бұл зерттеушілер HGPS пациенттерінің қан үлгілерінде тікелей фарнецирленген прогериннің мөлшерін анықтауға мүмкіндік беретін әдістемені жақсартуға тырысуда. Сәтті болған жағдайда бұл әдіс ғалымдарға адамдардағы эксперименттік емдеудің тиімділігін бағалау және осы аурудың дамуы мен ауырлығын бақылау үшін баға жетпес құрал береді.
Доктор Хесус Васкес Complutense университетінде (Мадрид, 1982) физикалық химия мамандығы бойынша бітірді және биохимия бойынша PhD дәрежесін Универсидад Автономасында (Мадрид, 1986) орындады, екеуі де ерекше ерекшелікпен. Merck Sharp Research Laboratories (NJ, АҚШ) және Centro de Biología Molecular Severo Ochoa (Мадрид) орталығында докторантурадан кейінгі оқу кезінде ол ақуыз химиясы мен нейрохимиялық аурулар контекстіндегі биомембраналарды зерттеуге маманданған. Содан бері ол Испанияда ақуыз химиясы, масс-спектрометрия және протеомиканың дамуында пионерлік рөл атқарды. Оның зертханасы пептидтерді фрагментациялау механизмдері, жаңа пептидтер секвенциясы және посттрансляциялық модификацияларды талдау сияқты тақырыптарды шешуге тиісті үлестерін қосты. Соңғы жылдары ол екінші буын әдістерін дамытуға, тұрақты изотопты таңбалау арқылы салыстырмалы протеомды сандық анықтауға, сандық деректерді интеграциялау және жүйелік биологияға арналған жетілдірілген алгоритмдерге және тотығу стрессінен туындаған модификациялардың жоғары өнімділік сипаттамасына көп күш жұмсады. Бұл әдістер бірнеше ғылыми жобаларға қолданылды, онда ол эндотелийдегі ангиогенез және азот тотығу стрессі, кардиомиоциттер мен митохондриялардағы ишемияның алдын-алу және иммундық синапс пен экзосомалардағы интерактомдар сияқты процестердің негізінде жатқан молекулалық механизмдерді зерттейді. Жүзден астам халықаралық басылымдардың авторы, ол CSIC профессоры де Investigación және RIC протеомика платформасының (Испандық жүрек-қан тамырлары зерттеулер желісі) директоры. Ол 2011 жылы CNIC-ке толық профессор ретінде қосылды, онда ол жүрек-қан тамырлары протеомикасы зертханасын басқарады және сонымен қатар протеомика бөліміне жауапты.
 Біздің мақсатымыз – қазіргі емдеуді ілгерілету және Хатчинсон-Гилфорд Прогерия синдромы (HGPS) және ықтимал жүрек-қантамыр аурулары (КВД) үшін жаңа терапияны әзірлеу және бағалау мақсатында биомаркерді анықтау арқылы аурудың дамуы мен прогрессиясы туралы ұжымдық түсінікті жақсарту. жалпы халық. Бүгінгі күнге дейін бар жоқ кімнің өршу қаупі бар екенін немесе терапияға кім жауап беретінін анықтаудың дәйекті қабілеті. Клиникалық нұсқауларды, диагностиканы және басқаруды стандарттау үшін нақты, анықталатын маркерге немесе маркерлер тақтасына негізделген дәл сынақтар өте маңызды. Біз HGPS және ықтимал қартаю және жүрек-қан тамырлары ауруларының аз инвазивті биомаркерлерін табу және растау мақсатына жету үшін протеомиканы ашудың заманауи тәсілін қолданғымыз келеді. HGPS осы зерттеулерінде алынған түсінік HGPS негізінде жатқан механизмдер туралы білімімізді хабардар етеді және айтарлықтай кеңейтеді. Сондай-ақ осы зерттеулерде жасалған биомаркердің ашылуы HGPS, CVD және қартаюға байланысты басқа да бұзылулар үшін әлеуетті терапиялық мақсаттарды көрсете алатын күшті әлеует бар.
Біздің мақсатымыз – қазіргі емдеуді ілгерілету және Хатчинсон-Гилфорд Прогерия синдромы (HGPS) және ықтимал жүрек-қантамыр аурулары (КВД) үшін жаңа терапияны әзірлеу және бағалау мақсатында биомаркерді анықтау арқылы аурудың дамуы мен прогрессиясы туралы ұжымдық түсінікті жақсарту. жалпы халық. Бүгінгі күнге дейін бар жоқ кімнің өршу қаупі бар екенін немесе терапияға кім жауап беретінін анықтаудың дәйекті қабілеті. Клиникалық нұсқауларды, диагностиканы және басқаруды стандарттау үшін нақты, анықталатын маркерге немесе маркерлер тақтасына негізделген дәл сынақтар өте маңызды. Біз HGPS және ықтимал қартаю және жүрек-қан тамырлары ауруларының аз инвазивті биомаркерлерін табу және растау мақсатына жету үшін протеомиканы ашудың заманауи тәсілін қолданғымыз келеді. HGPS осы зерттеулерінде алынған түсінік HGPS негізінде жатқан механизмдер туралы білімімізді хабардар етеді және айтарлықтай кеңейтеді. Сондай-ақ осы зерттеулерде жасалған биомаркердің ашылуы HGPS, CVD және қартаюға байланысты басқа да бұзылулар үшін әлеуетті терапиялық мақсаттарды көрсете алатын күшті әлеует бар.
Доктор Марша А. Мозес – Гарвард медициналық мектебінің Джулия Дакман Андрус профессоры және Бостон балалар ауруханасының тамырлы биология бағдарламасының директоры. Ол ісіктің өсуі мен дамуын реттеудің негізінде жатқан биохимиялық және молекулалық механизмдерді анықтауға және сипаттауға ұзақ уақыт бойы қызығушылық танытты. Доктор Мұса және оның зертханасы транскрипциялық және трансляциялық деңгейде жұмыс істейтін бірқатар ангиогенез ингибиторларын тапты, олардың кейбіреулері клиникаға дейінгі сынақта. Биомаркер медицинасының қызықты саласындағы пионері деп аталды Ұлттық онкологиялық институттың журналы, Доктор Мұса өз зертханасында протеомика бастамасын құрды, ол онкологиялық науқастардағы аурудың жай-күйі мен сатысын болжай алатын, сондай-ақ аурудың дамуының және қатерлі ісікке қарсы препараттардың емдік тиімділігінің сезімтал және дәл маркерлері болып табылатын инвазивті емес зәр шығару ісігі биомаркерлерінің панельдерінің ашылуына әкелді. . Бұл несеп сынақтарының бірқатары коммерциялық қол жетімді болды. Бұл диагностика мен емдік құралдар АҚШ және шетелдік патенттерден тұратын доктор Мұсаның маңызды патенттік портфолиосына кіреді.
сияқты журналдарда доктор Мұсаның негізгі және аударма жұмыстары жарияланған Ғылым, the Жаңа Англия медицина журналы, Ұяшық және Биологиялық химия журналы, басқалардың арасында. Доктор Мұса Ph.D дәрежесін алды. Бостон университетінің биохимия мамандығы бойынша және Бостон балалар ауруханасында және MIT-де Ұлттық денсаулық сақтау институтының постдокторлық стипендиясын аяқтады. Ол бірқатар NIH және қор гранттары мен марапаттарының иегері. Доктор Мосес Гарвард медициналық мектебінің тәлімгерлік марапаттарының екеуімен де, А. Клиффорд Баргердің тәлімгерлік сыйлығымен (2003) және Джозеф Б. Мартин Диннің Әйелдер факультетін дамытудағы көшбасшылық сыйлығымен (2009) танылды. 2013 жылы ол Американдық хирургтер колледжінің хирург әйелдер қауымдастығының құрметті мүшесі сыйлығын алды. Мұса докторы болып сайланды Медицина институты -ның Америка Құрама Штаттарының Ұлттық академиялары 2008 жылы және дейін Ұлттық өнертапқыштар академиясы 2013 жылы.
 Адено-ассоциирленген вирус (AAV) – жануарлар мен адамға вирустық емес гендер мен басқа емдік ДНҚ-ларды жеткізу үшін қолданылатын, ауру тудырмайтын шағын, ДНҚ вирусы. Вирус қабығына (вирион) оралған ДНҚ-ға вирустық гендер қосылмауы үшін, әр ұшында 145 негізді қоспағанда, бүкіл вирустық геномды жоюға болады. МикроРНҚ-лар (miRs) - бұл белок(тардың) сәйкес хабаршы РНҚ-сына кедергі жасау арқылы ақуыз экспрессиясын төмендететін РНҚ-ның кішкене бөліктері. Зерттеулер көрсеткендей, A Lamin (LMNA) мида жоғары деңгейде көрсетілмейді және мидағы miR-9 экспрессиясы бұл басуға жауап береді. Біз miR-9-ды AAV геномында жинаймыз және адамның прогериясы мен жасына сәйкес прогериялық емес жасушалық линиялардағы LMNA басылу деңгейін зерттейміз. Сонымен қатар, біз miR-9 және LMNA (оларды miR-9 арқылы басу мүмкін емес) AAV-ге орап, прогерияның фенотипін құтқару үшін жасушаларды зерттейміз. Егер бұл қадамдар сәтті болса, біз оларды Progeria тінтуірінің үлгісінде қайталаймыз.
Адено-ассоциирленген вирус (AAV) – жануарлар мен адамға вирустық емес гендер мен басқа емдік ДНҚ-ларды жеткізу үшін қолданылатын, ауру тудырмайтын шағын, ДНҚ вирусы. Вирус қабығына (вирион) оралған ДНҚ-ға вирустық гендер қосылмауы үшін, әр ұшында 145 негізді қоспағанда, бүкіл вирустық геномды жоюға болады. МикроРНҚ-лар (miRs) - бұл белок(тардың) сәйкес хабаршы РНҚ-сына кедергі жасау арқылы ақуыз экспрессиясын төмендететін РНҚ-ның кішкене бөліктері. Зерттеулер көрсеткендей, A Lamin (LMNA) мида жоғары деңгейде көрсетілмейді және мидағы miR-9 экспрессиясы бұл басуға жауап береді. Біз miR-9-ды AAV геномында жинаймыз және адамның прогериясы мен жасына сәйкес прогериялық емес жасушалық линиялардағы LMNA басылу деңгейін зерттейміз. Сонымен қатар, біз miR-9 және LMNA (оларды miR-9 арқылы басу мүмкін емес) AAV-ге орап, прогерияның фенотипін құтқару үшін жасушаларды зерттейміз. Егер бұл қадамдар сәтті болса, біз оларды Progeria тінтуірінің үлгісінде қайталаймыз.
Джозеф Рабиновиц, PhD, Филадельфиядағы Пенсильваниядағы Temple университетінің Медицина мектебінің трансляциялық медицина фармакология орталығының ассистенті. Доктор Рабиновиц Огайо штатындағы Кливленд штатындағы Кейс Вестерн Резерв университетінде генетика бойынша PhD дәрежесін алды (профессор Терри Магнусон, PhD). Ол өзінің докторантурадан кейінгі зерттеулерін Солтүстік Каролина университетінде Чапел Хиллдегі Гендік терапия орталығында жүргізді (Р. Джуде Самульски, директор) ол гендік терапия құралы ретінде аденомен байланысты вируспен жұмыс істей бастаған кезде. 2004 жылы Томас Джефферсон университетінің факультетіне қосылды, оның зертханасының басты мақсаты жүрекке генді жеткізу құралы ретінде Аденомен байланысты вирус серотиптерін әзірлеу болды. 2012 жылы ол Темпл университетінің медицина мектебіне ауысты және вирустық вектор ядросының директоры. Вирустарды тәжірибелік жануарларға терапевтік гендерді жеткізу құралы ретінде және адамдарға клиникалық сынақтарда қолдануға болады.
 Негізгі зерттеуші: Висенте Андрес, PhD, Молекулярлық және генетикалық жүрек-қан тамырлары патофизиологиясы зертханасы, Эпидемиология, атеротромбоз және бейнелеу бөлімі, Centro Nacional de Investigaciones Cardiovasculares (CNIC), Мадрид, Испания.
Негізгі зерттеуші: Висенте Андрес, PhD, Молекулярлық және генетикалық жүрек-қан тамырлары патофизиологиясы зертханасы, Эпидемиология, атеротромбоз және бейнелеу бөлімі, Centro Nacional de Investigaciones Cardiovasculares (CNIC), Мадрид, Испания.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) мутациялардан туындайды LMNA прогериннің өндірілуіне әкелетін ген, улы фарнезил модификациясын сақтайтын анормальды ақуыз. HGPS пациенттері кең таралған атеросклерозды көрсетеді және негізінен 13,4 жаста орташа миокард инфарктісі немесе инсульттан өледі, бірақ прогериннің жүрек-қан тамырлары ауруларын (ЖҚА) жеделдететін механизмдері туралы өте аз мәлімет бар. Сондықтан HGPS емдеу әдісін табу үшін клиникаға дейінгі зерттеулер қажет.
Кең таралған ауруларға арналған сынақтардан айырмашылығы, HGPS пациенттеріне арналған клиникалық сынақтар әрқашан шағын когорта мөлшерімен шектеледі. Сондықтан жануарлардың ең қолайлы үлгілерінде клиникаға дейінгі зерттеулер жүргізу өте маңызды. Қазіргі уақытта генетикалық түрлендірілген тінтуір үлгілері HGPS клиникаға дейінгі зерттеулерінің алтын стандарты болып табылады. Дегенмен, тышқандар адам патологиясының барлық аспектілерін шынайы түрде қайталамайды. Кеміргіштермен салыстырғанда шошқалар денесі мен мүшелерінің көлемі, анатомиясы, ұзақ өмір сүруі, генетикасы және патофизиологиясы бойынша адамға көбірек ұқсайды. Бір қызығы, шошқалардағы атеросклероз адам ауруының негізгі морфологиялық және биохимиялық сипаттамаларын, оның ішінде негізінен қолқада, коронарлық артерияларда және ұйқы артерияларында жиналатын атеросклеротикалық бляшкалардың пішіні мен таралуын мұқият қайталайды. Біздің негізгі мақсатымыз - генетикалық түрлендірілген шошқаларды тасымалдау және оларды сипаттау LMNA c.1824C>T мутациясы, HGPS пациенттерінде жиі кездесетін мутация. Осы үлкен жануар үлгісін қолданатын зерттеулер прогериядағы жүрек-қан тамырлары аурулары туралы негізгі білімімізде үлкен жетістіктерге жетуге және тиімді клиникалық қолданбаларды әзірлеуді тездетуге мүмкіндік береді.
Висенте Андрес Барселона университетінде биология ғылымдары бойынша PhD дәрежесін алды (1990). Гарвард университетінің балалар ауруханасында (1991-1994) және Тафтс университетіндегі Сент-Элизабет медициналық орталығында (1994-1995) постдокторлық дайындық кезінде ол жасушалық дифференциация мен пролиферация процестеріндегі гомеобокс пен MEF2 транскрипция факторларының рөлін зерттеуге жетекшілік етті. ; Сондай-ақ осы кезеңде ол жүрек-қан тамырларын зерттеуге қызығушылық танытты. Оның тәуелсіз зерттеуші ғалым ретіндегі мансабы 1995 жылы Тафтста медицина кафедрасының ассистенті болып тағайындалған кезде басталды. Содан бері доктор Андрес және оның тобы атеросклероз және ангиопластикадан кейінгі рестеноз кезінде тамырлардың қайта құрылуын зерттеді және жақында олар жүрек-қан тамырлары аурулары мен қартаюда сигнал беруді, ген экспрессиясын және жасушалық цикл белсенділігін реттеудегі ядролық қабықтың рөлін зерттеді. , А типті ламиндерге және Хатчинсон-Гилфорд прогериясына ерекше назар аудара отырып синдромы (HGPS).
Испанияның Ұлттық зерттеу кеңесінде (CSIC) тұрақты зерттеуші ғалым лауазымын алғаннан кейін, доктор Андрес 1999 жылы Испанияға оралып, Валенсия биомедицина институтында өзінің зерттеу тобын құрды, ол жерде толық профессор болып жұмыс істеді. 2006 жылдан бастап оның тобы Red Temática de Investigación Cooperativa enfermedades Cardiovasculares (RECAVA) мүшесі болды. Ол Centro Nacional de Investigaciones Cardiovasculares (CNIC) 2009 жылдың қыркүйегінде қосылды. 2010 жылы Бельгиялық кардиология қоғамының доктор Леон Дюмон сыйлығымен марапатталды.

NIH-те Прогерияның тінтуір моделі әзірленді, ол Прогериясы бар балаларда байқалатын тірек-қимыл аппаратының бірдей сипаттамаларына ие. Осы уақытқа дейін жануарлардың осы үлгісінде тірек-қимыл аппаратының прогериялық ерекшеліктерін терең бағалау жүргізілген жоқ. Атап айтқанда, буын қаттылығы мәселесі де егжей-тегжейлі бағаланбаған және бұл терідегі, бұлшықеттегі, буын капсуласындағы, артикулярлық шеміршектегі немесе буын деформациясының өзгеруінің салдары екені белгісіз.
Біз тінтуірдің осы үлгісін қаңқа мен тамырлар мен буындардың жалпы дене CAT сканерлеуін пайдалана отырып мұқият бағалауды жүргіземіз. Біз сондай-ақ сүйек пішініндегі өзгерістерді (қалыпты жануармен салыстырғанда), қан тамырларының кальцинациясын, бас сүйек пен терідегі өзгерістерді сипаттау үшін сүйек, шеміршек және теріге биомеханикалық зерттеулер жүргіземіз.
Біз сондай-ақ осы фенотиптік өзгерістердің өзара байланысты дәрежесін және бұл өзгерістерді аурудың ауырлығын және емдеуге жауапты бақылау үшін пайдалануға болатынын бағалаймыз. Мысалы, тірек-қозғалыс жүйесіндегі өзгерістер қан тамырларындағы өзгерістерді болжауға бола ма?
Брайан Д.Снайдер, MD, Ph.D. Бостон балалар ауруханасының персоналының сертификатталған балалар ортопедиялық хирургы болып табылады, оның клиникалық тәжірибесі жамбас дисплазиясына және жамбас, омыртқаның деформациясы, церебральды сал ауруы және балалар жарақатына қатысты жүре пайда болған деформацияларға бағытталған. Ол Бостон балалар ауруханасының церебральды сал ауруы клиникасының директоры. Сонымен қатар, ол Гарвард медициналық мектебінің ортопедиялық хирургия кафедрасының доценті және Бет Израиль Диконес медициналық орталығындағы (бұрынғы ортопедиялық биомеханика зертханасы) Жетілдірілген ортопедиялық зерттеулер орталығының (CAOS) директорының орынбасары. Зертхана – Гарвард университетінің, Массачусетс технологиялық институтының, Бостон университетінің, Гарвард медициналық мектебінің және Гарвардтың аралас ортопедиялық резидентура бағдарламасының биоинженерия кафедраларымен байланысты көп салалы негізгі ғылыми-зерттеу мекемесі. Доктор Снайдер Зертханада жасалған күрделі аналитикалық әдістерді тірек-қимыл аппараты ауруларын емдеуге арналған Балалар ауруханасында жасалған инновациялық диагностикалық және хирургиялық әдістермен біріктірді. Доктор Снайдердің тобы тірек-қимыл аппаратының биомеханикасындағы іргелі және қолданбалы зерттеулерге назар аударады, соның ішінде: сүйек құрылымы мен меншік қатынастарының сипаттамасы; метаболикалық сүйек ауруларының және метастаздық қатерлі ісіктің салдары ретіндегі патологиялық сынықтардың алдын алу; омыртқа жарақатының механизмдерін биомеханикалық талдау және синовиальды буындардағы гиалинді шеміршектердің биохимиялық және биомеханикалық қасиеттерін бағалау технологиясын жасау. Доктор Снайдер CT-негізделген құрылымдық қаттылықты талдау бағдарламалық пакетін пайдалана отырып, Хатчинсон-Гилфорд Прогерия синдромына (HGPS) әкелетін LMNA геніндегі G609G генінің мутациясының гомозиготалы тінтуір моделінің осьтік және аппендикулярлық қаңқасындағы өзгерістерді талдайды. Қатерлі және қатерлі ісіктері бар балалар мен ересектердегі сыну қаупін дәл болжау үшін әзірленген және расталған сүйек ісіктерін анықтау және Прогериядан зардап шеккен балалардағы аппендикулярлық қаңқаның емдеуге жауабын өлшеу.
 Хатчинсон-Гилфорд прогерия синдромы (HGPS) – сирек сегменттік ерте қартаю ауруы, онда зардап шеккен балалар жедел қартаюдың бірнеше фенотиптік сипаттамаларына ие болады. HGPS жағдайларының көпшілігі бастапқы транскрипттегі криптикалық қосылыс орнын белсендіретін А ламинасын (LA) кодтайтын геннің жаңа мутациясынан туындайды. Алынған мРНҚ прогерин деп аталатын карбоксил терминалдық доменінде 50 амин қышқылының жойылуымен тұрақты фарнесилденген LA кодтайды. Бұл тұрақты фарнезилирленген прогерин аурудың қоздырғышы екендігі дәлелденгенімен, анормальды ақуыздың әсер ету механизмі белгісіз болып қалады. Жақында доктор Голдман және басқалар LA-дағы көптеген пост-аудармалық модификациялық сайттарды картаға түсірді. Жақында ол LA құрылымсыз α-спиральді емес C- және N- терминалдық домендерінде фосфорланған серин мен треонин қалдықтарының үш түрлі аймағын қамтитынын байқады. Осы аймақтардың бірі толығымен прогеринде жойылған 50 аминқышқылды пептидтің ішінде болады, бұл бұл аймақ пен оның трансляциядан кейінгі модификациясы LA өңдеу мен функцияға қатысуы мүмкін дегенді білдіреді. Оның зертханасы сонымен қатар интерфаза кезінде фосфорланудың жоғары айналымы бар бірнеше фосфорлану орындарын анықтады. Оларға ламинді бөлшектеу және митоз кезінде жинау үшін маңызды болып табылатын екі негізгі фосфорлану учаскелері кіреді. Тағы бір жоғары айналым учаскесі аймақта карбоксил ұшына жақын орналасқан және прогеринде жойылады. Алдын ала эксперименттер бұл жоғары айналым учаскелері LA локализациясы мен қозғалғыштығын реттеуге қатысатынын көрсетеді. Доктор Голдман LA мен прогеринді өңдеуде, локализациялауда, қозғалғыштығында және ламина құрылымына жинақтауда арнайы учаскеге тән фосфорланудың рөлін зерттейді. Ұсынылған зерттеулер LA ішіндегі нақты сайттардың, әсіресе прогеринде жойылғандардың посттрансляциялық модификацияларының функциясына жаңа жарық түсіруі мүмкін. Нәтижелер HGPS этиологиясы туралы жаңа түсініктер беруі керек. Осы зерттеулердің нәтижелері, сонымен қатар, ламиндік функцияларды реттеу үшін маңызды болып табылатын LA модификацияларына бағытталған HGPS пациенттері үшін жаңа терапевтік араласуларға нұсқауы мүмкін.
Хатчинсон-Гилфорд прогерия синдромы (HGPS) – сирек сегменттік ерте қартаю ауруы, онда зардап шеккен балалар жедел қартаюдың бірнеше фенотиптік сипаттамаларына ие болады. HGPS жағдайларының көпшілігі бастапқы транскрипттегі криптикалық қосылыс орнын белсендіретін А ламинасын (LA) кодтайтын геннің жаңа мутациясынан туындайды. Алынған мРНҚ прогерин деп аталатын карбоксил терминалдық доменінде 50 амин қышқылының жойылуымен тұрақты фарнесилденген LA кодтайды. Бұл тұрақты фарнезилирленген прогерин аурудың қоздырғышы екендігі дәлелденгенімен, анормальды ақуыздың әсер ету механизмі белгісіз болып қалады. Жақында доктор Голдман және басқалар LA-дағы көптеген пост-аудармалық модификациялық сайттарды картаға түсірді. Жақында ол LA құрылымсыз α-спиральді емес C- және N- терминалдық домендерінде фосфорланған серин мен треонин қалдықтарының үш түрлі аймағын қамтитынын байқады. Осы аймақтардың бірі толығымен прогеринде жойылған 50 аминқышқылды пептидтің ішінде болады, бұл бұл аймақ пен оның трансляциядан кейінгі модификациясы LA өңдеу мен функцияға қатысуы мүмкін дегенді білдіреді. Оның зертханасы сонымен қатар интерфаза кезінде фосфорланудың жоғары айналымы бар бірнеше фосфорлану орындарын анықтады. Оларға ламинді бөлшектеу және митоз кезінде жинау үшін маңызды болып табылатын екі негізгі фосфорлану учаскелері кіреді. Тағы бір жоғары айналым учаскесі аймақта карбоксил ұшына жақын орналасқан және прогеринде жойылады. Алдын ала эксперименттер бұл жоғары айналым учаскелері LA локализациясы мен қозғалғыштығын реттеуге қатысатынын көрсетеді. Доктор Голдман LA мен прогеринді өңдеуде, локализациялауда, қозғалғыштығында және ламина құрылымына жинақтауда арнайы учаскеге тән фосфорланудың рөлін зерттейді. Ұсынылған зерттеулер LA ішіндегі нақты сайттардың, әсіресе прогеринде жойылғандардың посттрансляциялық модификацияларының функциясына жаңа жарық түсіруі мүмкін. Нәтижелер HGPS этиологиясы туралы жаңа түсініктер беруі керек. Осы зерттеулердің нәтижелері, сонымен қатар, ламиндік функцияларды реттеу үшін маңызды болып табылатын LA модификацияларына бағытталған HGPS пациенттері үшін жаңа терапевтік араласуларға нұсқауы мүмкін.
Роберт Д.Голдман, PhD докторы, Стивен Уолтер Рэнсонның профессоры және Солтүстік-Батыс университетінің Файнберг медицина мектебінің жасуша және молекулалық биология кафедрасының төрағасы. Ол цитоскелеттік және ядролық қимыл-қозғалыс аралық жіпшелік жүйелердің құрылымы мен қызметі туралы авторитет. Ол және оның әріптестері 240-тан астам ғылыми мақалалар жариялады. Оның жұмысы бірқатар марапаттар мен марапаттарға, соның ішінде адамның қартаюы бойынша Эллисон қорының аға ғалымы сыйлығына және Ұлттық жалпы медицина ғылымдары институтының MERIT сыйлығына әкелді. Доктор Голдман Америка ғылымды дамыту қауымдастығының мүшесі және 1997-2001 жылдар аралығында оның директорлар кеңесінде қызмет етті. Ол ғылыми қоғамдастықта көптеген лауазымдарды атқарды, соның ішінде Cold Spring Harbor зертханасы үшін кездесулер ұйымдастыру және монографиялар мен зертханалық нұсқаулықтарды редакциялау және Американдық қатерлі ісік қоғамы мен NIH үшін шолу комитеттерінде қызмет етті. Американдық жасуша биологиясы қоғамының және американдық анатомия, жасуша биологиясы және нейробиология төрағалары қауымдастығының президенті болды. Голдман Теңіз биологиялық зертханасында (MBL) Ғылым жазушыларымен жұмыс жасау бағдарламасының негізін қалады және басқарды және MBL Қамқоршылар кеңесінде, MBL физиология курсының директоры және MBL Уитман зерттеу орталығының директоры болды. Ол FASEB журналының, жасушаның молекулалық биологиясы және биоархитектурасының редакторының орынбасары. Ол сондай-ақ қартаю жасушаларының және ядролардың редакциялық кеңестерінде қызмет етеді.
 Ламин А ақуызының көптігін бақылайтын молекулалық механизмдер жақсы түсінілмеген. Ішкі ядролық мембрана ақуызы Man1 адам жасушаларында ламин А-ның жиналуын болдырмайтынын көрсеттік. Біз Man1 сонымен қатар Хатчисон-Гилфорд прогерия синдромын (HGPS) тудыратын Ламин А-ның мутантты түрі прогериннің жинақталуын шектеу үшін әрекет ете ме, жоқ па, егер солай болса, бұл жол жинақталуын кешіктіретін немесе алдын алатын терапевтика үшін жаңа мақсат болып табылатынын анықтаймыз. HGPS бар балалардағы прогерин.
Ламин А ақуызының көптігін бақылайтын молекулалық механизмдер жақсы түсінілмеген. Ішкі ядролық мембрана ақуызы Man1 адам жасушаларында ламин А-ның жиналуын болдырмайтынын көрсеттік. Біз Man1 сонымен қатар Хатчисон-Гилфорд прогерия синдромын (HGPS) тудыратын Ламин А-ның мутантты түрі прогериннің жинақталуын шектеу үшін әрекет ете ме, жоқ па, егер солай болса, бұл жол жинақталуын кешіктіретін немесе алдын алатын терапевтика үшін жаңа мақсат болып табылатынын анықтаймыз. HGPS бар балалардағы прогерин.
Тофер Кэррол Сан-Франциско Калифорния университетінде Дэвид Морганның зертханасында магистрант болды, онда ол анафазаны көтермелеу кешенінің энзимологиясын зерттеді. Содан кейін ол центромералардың жиналуы мен таралуын реттейтін эпигенетикалық механизмдерді зерттеу үшін Стэнфорд университетінің биохимия департаментіндегі Аарон Стрейттің зертханасына барды. Тофер 2012 жылдың көктемінде Йель университетінің жасушалық биология кафедрасында өз зертханасын бастады. Оның зертханасы ядролық ұйымға және оның хроматин құрылымымен және адам ауруымен байланысына қызығушылық танытады.
 Бұл жоба прогерин деп аталатын ламин А мутацияланған түрінің экспрессиясына әкелетін А ламинасындағы мутацияның Nup153 ақуызының қызметін қалай өзгертетінін шешу арқылы Хатчинсон-Гилфорд прогерия синдромының (HGPS) этиологиясы туралы жаңа түсінік алуға бағытталған. ДНҚ зақымдануы аясында. Nup153 ядролық кеуек кешені деп аталатын үлкен құрылымның құрамдас бөлігі болып табылады және жақында ДНҚ зақымдалуына жасушалық жауапқа қатысатыны танылды. Ламин А Nup153-пен әрекеттесетіні белгілі және сонымен қатар ДНҚ зақымдалуына жауап беруге қатысады. Біз бұл функционалдық қиылысты зерттейміз және жаңа ақпаратты HGPS контекстіне жылдам біріктіру мақсатымен осы байланыстарға негізделеміз.
Бұл жоба прогерин деп аталатын ламин А мутацияланған түрінің экспрессиясына әкелетін А ламинасындағы мутацияның Nup153 ақуызының қызметін қалай өзгертетінін шешу арқылы Хатчинсон-Гилфорд прогерия синдромының (HGPS) этиологиясы туралы жаңа түсінік алуға бағытталған. ДНҚ зақымдануы аясында. Nup153 ядролық кеуек кешені деп аталатын үлкен құрылымның құрамдас бөлігі болып табылады және жақында ДНҚ зақымдалуына жасушалық жауапқа қатысатыны танылды. Ламин А Nup153-пен әрекеттесетіні белгілі және сонымен қатар ДНҚ зақымдалуына жауап беруге қатысады. Біз бұл функционалдық қиылысты зерттейміз және жаңа ақпаратты HGPS контекстіне жылдам біріктіру мақсатымен осы байланыстарға негізделеміз.
Кэти Ульман Солтүстік-Батыс университетінде бакалавр дәрежесін алды, содан кейін Стэнфорд университетінде PhD докторантурасына түсті. Калифорния университетінде, Сан-Диегода докторлық дәрежесін алған соң, ол 1998 жылы Юта университетінің профессорлық-оқытушылық құрамына қосылды. Кэти онкологиялық ғылымдар және биохимия кафедраларының мүшесі, сонымен қатар Хантсман онкологиялық институтында тергеуші болып табылады. Ол Burroughs Wellcome қорының биомедициналық ғылымдар саласындағы мансаптық марапатының иегері және онкологиялық орталықтағы жасушаларға жауап беру және реттеу бағдарламасын бірге басқарады.
 Прогерин А ламинінің «табиғи емес» түрі ретінде қарастырылды. Дегенмен, жаңа жұмыс прогериннің адам ағзасындағы екі нақты уақытта және жерінде — туғаннан кейін жаңа туған жүректің қайта құрылуы кезінде (артериоз түтігінің жабылуы) жоғары деңгейде көрінетінін көрсетеді. ), және ультракүлгін (УК-А) сәулесінің әсеріне ұшыраған жасушаларда (фибробласттарда). Бұл прогериннің белгілі бір уақытта белгілі (белгісіз) себептермен экспрессияланатын табиғи ген өнімі екенін көрсетеді. Прогериннің осы ұсынылған «табиғи» рөлдері туралы негізгі түсінік HGPS-те терапевтік мақсатқа жетуге болатын жаңа жолдарды анықтауы мүмкін. Жаңа туған сиыр жүректерінен және УКА сәулеленген фибробласттардан бастап, бұл жоба прогеринмен байланысатын ақуыздарды тазартады және анықтайды және олардың HGPS-ке белгілі немесе ықтимал әсерін бағалайды. Біз сондай-ақ прогериннің маңызды ферменттің ('OGT'; O-GlcNAc Трансфераза) реттелуінен құтылу мүмкіндігін тексереміз, ол әдетте кішкентай қанттың көптеген көшірмелерімен ("GlcNAc") ламин А құйрығын "белгілейді". Бұл жоба прогеринге қарсы ламинадағы қантпен модификацияланған учаскені(лерді) анықтайды, бұл модификациялар сау ламин функцияларына ықпал ететінін сұрайды және HGPS клиникалық сынақтарында оларға дәрілер әсер еткенін анықтайды.
Прогерин А ламинінің «табиғи емес» түрі ретінде қарастырылды. Дегенмен, жаңа жұмыс прогериннің адам ағзасындағы екі нақты уақытта және жерінде — туғаннан кейін жаңа туған жүректің қайта құрылуы кезінде (артериоз түтігінің жабылуы) жоғары деңгейде көрінетінін көрсетеді. ), және ультракүлгін (УК-А) сәулесінің әсеріне ұшыраған жасушаларда (фибробласттарда). Бұл прогериннің белгілі бір уақытта белгілі (белгісіз) себептермен экспрессияланатын табиғи ген өнімі екенін көрсетеді. Прогериннің осы ұсынылған «табиғи» рөлдері туралы негізгі түсінік HGPS-те терапевтік мақсатқа жетуге болатын жаңа жолдарды анықтауы мүмкін. Жаңа туған сиыр жүректерінен және УКА сәулеленген фибробласттардан бастап, бұл жоба прогеринмен байланысатын ақуыздарды тазартады және анықтайды және олардың HGPS-ке белгілі немесе ықтимал әсерін бағалайды. Біз сондай-ақ прогериннің маңызды ферменттің ('OGT'; O-GlcNAc Трансфераза) реттелуінен құтылу мүмкіндігін тексереміз, ол әдетте кішкентай қанттың көптеген көшірмелерімен ("GlcNAc") ламин А құйрығын "белгілейді". Бұл жоба прогеринге қарсы ламинадағы қантпен модификацияланған учаскені(лерді) анықтайды, бұл модификациялар сау ламин функцияларына ықпал ететінін сұрайды және HGPS клиникалық сынақтарында оларға дәрілер әсер еткенін анықтайды.
Кэтрин Уилсон, PhD докторы, Кэтрин Л. Вилсон Тынық мұхитының солтүстік-батысында өсті. Ол Сиэтлде (BS, Вашингтон университеті) микробиологияны, Сан-Францискода биохимия және генетиканы (PhD, UCSF) оқыды және Сан-Диегода (UCSD) постдокторант ретінде ядролық құрылымды зерттей бастады. Содан кейін ол Балтимордағы Джонс Хопкинс университетінің Медицина мектебінің факультетіне қосылды, онда жасуша биологиясының профессоры. Оның зертханасы бұл белоктардағы мутациялардың бұлшықет дистрофиясын, жүрек ауруын, липодистрофияны, Хатчинсон-Гилфордты қалай тудыратынын түсіну үшін ядролық «ламин» құрылымын құрайтын ақуыздардың (ламиндер, LEM-домен белоктары және олардың жұмбақ серіктесі, BAF) «үштігін» зерттейді. Прогерия синдромы және Нестор-Гильермо прогерия синдромы.
 Ол әлемдегі ең үлкен егде жастағы халық тұратын Тынық мұхиты аймағында қартаюды зерттеуге белсенді қатысады. Ол Қытайдағы Гуандун медициналық колледжінің қартаюды зерттеу институтында шақырылған профессор. Ол сонымен қатар Сиэтлдегі Вашингтон университетінің биохимия кафедрасының серіктес профессоры.
Ол әлемдегі ең үлкен егде жастағы халық тұратын Тынық мұхиты аймағында қартаюды зерттеуге белсенді қатысады. Ол Қытайдағы Гуандун медициналық колледжінің қартаюды зерттеу институтында шақырылған профессор. Ол сонымен қатар Сиэтлдегі Вашингтон университетінің биохимия кафедрасының серіктес профессоры.
А-типті ядролық ламиндердің мутациялары жүрек-қан тамырлары ауруларымен, бұлшықет дистрофиясымен және прогериямен байланысты ламинопатиялар деп аталатын бірқатар ауруларды тудырады. Олардың арасында C-терминалды өңдеу ламинасына әсер ететін және жедел қартаюға ұқсайтын прогероидты синдромдарды тудыратын ішкі жиын бар. Прогерияның қалыпты қартаюды тудыратын оқиғалармен механикалық байланысы бар ма деген сұрақ Вернер және Хатчисон-Гилфорд Прогерия синдромдарына қатысты ондаған жылдар бойы қартаю өрісін мазалап келді. Жақында қартаюды баяулататын (рапамицин) және жасқа байланысты созылмалы аурулардан (рапамицин және ресвератрол) қорғайтын шағын молекулалар анықталды. Егер прогерия қалыпты қартаюмен механикалық түрде байланысты болса, бұл кішігірім молекулалар және пайда болатын басқалар HGPS емдеуде тиімді агенттер болуы мүмкін. Бұл зерттеуде доктор Кеннедидің зертханасы аурудың патологиясын жақсартуға бағытталған ресвератрол мен рапамициннің (сонымен қатар екі агенттің де туындыларының) тиімділігін бағалау үшін прогерияның тышқан үлгілерін қолдануды жоспарлап отыр.
Брайан Кеннеди, PhD докторы, Бак Қартаю мәселелерін зерттеу институтының президенті және бас атқарушы директоры. Ол қартаюдың негізгі биологиясындағы зерттеулері үшін халықаралық деңгейде танылды және зерттеу жаңалықтарын анықтаудың, алдын алудың және емдеудің жаңа әдістеріне аударуға ұмтылған көреген адам ретінде танылды. жасқа байланысты жағдайлар. Оларға Альцгеймер және Паркинсон аурулары, онкологиялық аурулар, инсульт, қант диабеті және басқалар жатады. Ол Бак институтындағы 20 негізгі зерттеушілер тобын басқарады, олардың барлығы салауатты өмір сүру жылдарын ұзартуға бағытталған пәнаралық зерттеулерге қатысады.
А ламинасының өзгерген түрі прогериннің жиналуы Хатчинсон-Гилфорд Прогерия синдромын тудырады. Аурудың тамаша емі оның синтезін төмендету немесе оның ыдырауына ықпал ету арқылы прогериннің жиналуын болдырмауы керек. Дегенмен, ламин А немесе прогериннің қалыпты айналымы туралы аз мәлімет бар. Прогериннің ядролық қабатта жинақталуы фарнесилдену арқылы бақыланады. А ламинді фарнесилденуі оның 22 сериндегі фосфорлануын бақылайтынын анықтадық, бұл бұрын митоз кезінде ядролық ламинаның деполимеризациясымен байланысты оқиға. Дегенмен, біз S22 фосфорлануы интерфаза кезінде де болатынын және прогериннің бөліну фрагменттерінің генерациясымен байланысты екенін анықтадық. Біз прогерин айналымының жаңа жолын ұсынамыз, оған дефарнесилдену және S22 фосфорлануы кіреді. Бұл жолды молекулалық түсіну прогерияның жаңа емдік мүмкіндіктеріне әкелуі мүмкін деп ойлаймыз. Атап айтқанда, 22-сериндегі А ламинінің фосфорлануын реттейтін киназалар мен фосфатазаларды және А ламинасына делдалдық протеазаларды анықтау прогерин айналымын ынталандыратын және HGPS пациенттерін жақсартатын препараттарды анықтауға көмектеседі.
 Доктор Жерардо Фербейре 1987 жылы Гавана университетінің медициналық мектебін бітірді және Канададағы Монреаль университетінде биохимия бойынша PhD дәрежесін алды, онда ол рибозимдерді зерттеді. Ол Cold Spring Harbor зертханасында доктор Скотт Лоумен бірге постдокторлық дайындықтан өтті. Онда ол промиелоцитарлы лейкоз протеині PML мен онкогеннен туындаған қартаю арасындағы байланысты орнатты және жасушалық қартаюдың медиаторлары ретінде p53 және p19ARF рөлін зерттеді. 2001 жылдың қазан айында доктор Фербейр Монреаль университетінің биохимия кафедрасына қартаю және қатерлі ісіктерді емдеу үшін промиелоцитарлы лейкоз протеинін қайта белсендіру мүмкіндіктері туралы ғылыми зерттеулерін жалғастыру үшін қосылды. Оның зертханасының соңғы қосқан үлесіне ДНҚ-ның зақымдануы туралы сигналдың қартаюға делдалдық жасайтыны және А қабатының экспрессиясындағы ақаулар мен қартаю арасындағы байланыс бар екендігі ашылды.
Доктор Жерардо Фербейре 1987 жылы Гавана университетінің медициналық мектебін бітірді және Канададағы Монреаль университетінде биохимия бойынша PhD дәрежесін алды, онда ол рибозимдерді зерттеді. Ол Cold Spring Harbor зертханасында доктор Скотт Лоумен бірге постдокторлық дайындықтан өтті. Онда ол промиелоцитарлы лейкоз протеині PML мен онкогеннен туындаған қартаю арасындағы байланысты орнатты және жасушалық қартаюдың медиаторлары ретінде p53 және p19ARF рөлін зерттеді. 2001 жылдың қазан айында доктор Фербейр Монреаль университетінің биохимия кафедрасына қартаю және қатерлі ісіктерді емдеу үшін промиелоцитарлы лейкоз протеинін қайта белсендіру мүмкіндіктері туралы ғылыми зерттеулерін жалғастыру үшін қосылды. Оның зертханасының соңғы қосқан үлесіне ДНҚ-ның зақымдануы туралы сигналдың қартаюға делдалдық жасайтыны және А қабатының экспрессиясындағы ақаулар мен қартаю арасындағы байланыс бар екендігі ашылды.
Доктор Мистели командасы Прогерияға арналған жаңа терапиялық стратегияларды әзірлеуде. Оның тобының жұмысы молекулалық құралдарды пайдалана отырып, прогерин протеинін өндіруге кедергі келтіруге және пациент жасушаларында прогериннің зиянды әсеріне қарсы тұру үшін жаңа шағын молекулаларды табуға бағытталған. Бұл күш-жігер Progeria жасушаларын егжей-тегжейлі жасушалық биологиялық түсінуге әкеледі және бізді Progeria үшін молекулалық мақсатты терапияға жақындатады.

Том Мистели - тірі жасушалардағы геномдар мен ген экспрессиясын зерттеу үшін бейнелеу тәсілдерін қолданудың бастаушысы болған халықаралық танымал жасуша биологы. Ол NIH Ұлттық онкологиялық институтында аға тергеуші және директордың орынбасары. Оның зертханасының қызығушылығы – кеңістіктік геномды ұйымдастырудың іргелі принциптерін ашу және бұл білімді қатерлі ісік пен қартаюдың жаңа диагностикалық және терапиялық стратегияларын әзірлеуге қолдану. Ол Чарльз Университетінің Алтын медалін, Флемминг сыйлығын, Джан-Тондури сыйлығын, NIH директорының сыйлығын және NIH Merit Award сияқты көптеген марапаттарға ие болды. Ол көптеген ұлттық және халықаралық агенттіктердің кеңесшісі болып табылады және бірнеше редакциялық кеңестерде, соның ішінде Cell-де қызмет етеді. Ол The Journal of Cell Biology журналының және жасуша биологиясындағы қазіргі пікірдің бас редакторы.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) ламин А генінің мутациясынан туындайды, ол прогерин деп аталатын мутантты преламин А ақуызының түзілуіне және жинақталуына әкеледі. Бұл ақуыз жиналып, ядролық компоненттер мен функцияларға кедергі жасайтындықтан, митоз және дифференциация кезінде прогериннің тікелей эффекторларын анықтау прогериннің жасушаларды ерте қартаюға әкелетін ядролық ақауларды қалай және қашан қоздыратынын түсіну үшін өте маңызды.
Бұл зерттеуде доктор Джабали зертханасы прогерин экспрессиясы арқылы бұзылатын бастапқы молекулалық өзара әрекеттесулерді анықтау үшін ядролық тірек, ядролық қабық және ядролық ішкі қабаттағы прогериннің тікелей эффекторларын анықтауды жоспарлайды. Осы мақсатта олар прогеринге қарсы антиденелерді және HGPS жасушалық үлгілерін, соның ішінде HGPS (PRF Cell Bank) бар емделушілерден алынған тері биопсияларынан құрылған фибробласттарды және теріден алынған прекурсорлық жасушаларды пайдаланады. Олар прогерин эффекторларын анықтау үшін биохимиялық және жасушалық бейнелеуді біріктіреді және олардың HGPS ауруының дамуына жауап беретін HGPS жасушаларында байқалатын типтік фенотиптік өзгерістерге әкелетін молекулалық оқиғаларға қосқан үлесін зерттейді. Осы зерттеулерден алынған түсініктер HGPS емдеу үшін жаңа терапевтік мақсаттарды және ықтимал араласулардың тиімділігін сынау үшін жаңа жасушалық соңғы нүктелерді анықтауға мүмкіндік береді. Біздің жұмысымыз бізді және HGPS саласындағы басқа командаларды HGPS бар балаларға ұзақ салауатты өмір сүруге көмектесетін ем(лерді) табуға жақындату үшін қажетті білімді береді деп үміттенеміз.

Карима Джабали, PhD докторы, Германияның Мюнхен техникалық университетінің тері аурулары және медициналық инженерия институтының (IMETUM) медицина факультетінің қартаю эпигенетикасының профессоры. Д-р Джабали биохимия бойынша магистр және PhD дәрежесін Париж VII университетінде алды. Диссертациялық жұмысын Колледж де Франста (Проф. Ф. Грос зертханасы, Франция) және Рокфеллер университетінде (Проф. Г. Блобел зертханасы, АҚШ) орындады. EMBL-де (Гайдельберг, Германия) постдокторлық зерттеулер жүргізді. Ол 1994 жылы Ұлттық ғылыми зерттеулер орталығында (CNRS, Франция) Chargé de recherche лауазымына ие болды және 1999 жылдан 2003 жылға дейін Нью-Йорктегі Колумбия университетінің (АҚШ) дерматология бөлімінде ғылыми-зерттеу бөлімінің ғылыми қызметкері қызметін атқарды. Содан кейін доктор Джабали Нью-Йорк Колумбия университетінің (АҚШ) дерматология кафедрасының доценті қызметін атқарды. 2004 және 2009. Доктор Джабалидің зерттеуі әдетте Хатчинсон-Гилфорд прогериялық синдромы (HGPS) сияқты ерте қартаю ауруларының молекулалық және жасушалық патогенезіне ерекше назар аудара отырып, қалыпты және ауру күйлеріндегі жасушалық қартаюға бағытталған. Оның зерттеулері молекулалық биологияны, жасушалық биологияны, генетиканы және протеомиканы біріктіреді және қартаю процестерін кешіктіру және/немесе түзету үшін профилактикалық стратегияларды әзірлеу үшін жасушалық қартаюмен байланысты сигнал беру жолдарын анықтайды.
Доктор Мистелидің зертханасы химиялық молекулалардың үлкен кітапханаларын скрининг арқылы HGPS препараттарын әзірлеу үшін қорғасын қосылыстарын анықтауға тырысады. Мамандық сыйлығы осы зерттеулерге қажетті роботтық зертханалық жабдықты сатып алу үшін пайдаланылды.
Том Мистели - тірі жасушалардағы геномдар мен ген экспрессиясын зерттеу үшін бейнелеу тәсілдерін қолданудың бастаушысы болған халықаралық танымал жасуша биологы. Ол NIH Ұлттық онкологиялық институтында аға тергеуші және директордың орынбасары. Оның зертханасының қызығушылығы – кеңістіктік геномды ұйымдастырудың іргелі принциптерін ашу және бұл білімді қатерлі ісік пен қартаюдың жаңа диагностикалық және терапиялық стратегияларын әзірлеуге қолдану. Ол Чарльз Университетінің Алтын медалін, Флемминг сыйлығын, Джан-Тондури сыйлығын, NIH директорының сыйлығын және NIH Merit Award сияқты көптеген марапаттарға ие болды. Ол көптеген ұлттық және халықаралық агенттіктерде кеңесші қызметін атқарады және бірнеше редакциялық кеңестерде қызмет етеді, соның ішінде Ұяшық. Бас редакторы Жасушалық биология журналы және Жасуша биологиясындағы қазіргі пікір.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) – мезгілсіз қартаюмен және орта есеппен 13 жаста өліммен сипатталатын сирек өлімге әкелетін генетикалық ауру. HGPS пациенттерінің көпшілігінде мутация бар LMNA ген (негізінен А ламинасын және С ламинасын кодтайды) улы фарнезил модификациясын сақтайтын анормальды ақуыз «прогерин» түзілуіне әкеледі. HGPS жасуша және тінтуір үлгілерімен жүргізілген тәжірибелер фарнецилденген прогериннің жалпы мөлшері мен прогериннің жетілген А ламиніне қатынасы прогериядағы аурудың ауырлығын анықтайтынын және өмір сүру ұзақтығының негізгі факторы болып табылатынын нақты көрсетті. Осылайша, жалғасып жатқан клиникалық сынақтар HGPS пациенттерінде прогерин фарнезиляциясын тежейтін препараттардың тиімділігін бағалауда. Бұл жобаның негізгі мақсаты - HGPS пациенттерінің жасушаларында прогерин экспрессиясын және оның фарнесилдену деңгейін және прогериннің жетілген А ламинасына қатынасын жүйелі және дәл сандық анықтау әдісін жасау. Бұл параметрлерді өлшеу прогериннің фарнезиляциясына бағытталған препараттардың тиімділігін, сондай-ақ прогериннің қалыпты емес өңделуін (сплайсинг) тежеу үшін әзірленген болашақ стратегиялардың тиімділігін бағалауға көмектеседі. LMNA mRNA, пациенттердің көпшілігінде HGPS себебі. Екінші мақсат - аберрантты белсендіретін механизмдерді анықтау үшін жоғары өнімділік стратегиясын әзірлеу үшін пилоттық зерттеулер жүргізу. LMNA қосу.
Висенте Андрес Барселона университетінде биология ғылымдары бойынша PhD дәрежесін алды (1990). Гарвард университетінің балалар ауруханасында (1991-1994) және Тафтс университетіндегі Сент-Элизабет медициналық орталығында (1994-1995) постдокторлық дайындық кезінде ол жасушалық дифференциация мен пролиферация процестеріндегі гомеобокс пен MEF2 транскрипция факторларының рөлін зерттеуге жетекшілік етті. ; Сондай-ақ осы кезеңде ол жүрек-қан тамырларын зерттеуге қызығушылық танытты. Оның тәуелсіз зерттеуші ғалым ретіндегі мансабы 1995 жылы Тафтста медицина кафедрасының ассистенті болып тағайындалған кезде басталды. Содан бері доктор Андрес және оның тобы атеросклероз және ангиопластикадан кейінгі рестеноз кезінде тамырлардың қайта құрылуын зерттеді және жақында олар жүрек-қан тамырлары аурулары мен қартаюда сигнал беруді, ген экспрессиясын және жасушалық цикл белсенділігін реттеудегі ядролық қабықтың рөлін зерттеді. , А типті ламиндерге және Хатчинсон-Гилфорд прогериясына ерекше назар аудара отырып синдромы (HGPS).
Испанияның Ұлттық зерттеу кеңесінде (CSIC) тұрақты зерттеуші ғалым лауазымын алғаннан кейін, доктор Андрес 1999 жылы Испанияға оралып, Валенсия биомедицина институтында өзінің зерттеу тобын құрды, ол жерде толық профессор болып жұмыс істеді. 2006 жылдан бастап оның тобы Red Temática de Investigación Cooperativa enfermedades Cardiovasculares (RECAVA) мүшесі болды. Ол Centro Nacional de Investigaciones Cardiovasculares (CNIC) 2009 жылдың қыркүйегінде қосылды. 2010 жылы Бельгиялық кардиология қоғамының доктор Леон Дюмон сыйлығымен марапатталды.
 Доктор Бенчимолдың p53 функциясы саласындағы жетістіктерінің ұзақ рекорды бар. Ол өзінің тәжірибесін қызықты алдын ала деректерге сүйене отырып және Хатчинсон-Гилфорд Прогерия синдромы (HGPS) пациенттерінің жасушалары көрсеткен мезгілсіз қартаюдағы p53 рөліне қатысты жаңа гипотезаларды сынау үшін пайдаланады. Бірінші мақсат прогерин репликация стрессін тудырады, бұл өз кезегінде қартаюдың өсуін тоқтатуды тудырады және p53 прогерин тудырған репликация стрессінің төменгі ағынында әрекет етеді деген гипотезаны тексеруге арналған. Бұл мақсаттан кейін прогерин мен p53 қартаю реакциясын тудыру үшін қалай әрекеттесетінін анықтауға арналған механикалық мақсат келеді.
Доктор Бенчимолдың p53 функциясы саласындағы жетістіктерінің ұзақ рекорды бар. Ол өзінің тәжірибесін қызықты алдын ала деректерге сүйене отырып және Хатчинсон-Гилфорд Прогерия синдромы (HGPS) пациенттерінің жасушалары көрсеткен мезгілсіз қартаюдағы p53 рөліне қатысты жаңа гипотезаларды сынау үшін пайдаланады. Бірінші мақсат прогерин репликация стрессін тудырады, бұл өз кезегінде қартаюдың өсуін тоқтатуды тудырады және p53 прогерин тудырған репликация стрессінің төменгі ағынында әрекет етеді деген гипотезаны тексеруге арналған. Бұл мақсаттан кейін прогерин мен p53 қартаю реакциясын тудыру үшін қалай әрекеттесетінін анықтауға арналған механикалық мақсат келеді.
2012 жылдың шілдесі: Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD; Мамандық марапатына түзету
Доктор Мистелидің зертханасы химиялық молекулалардың үлкен кітапханаларын скрининг арқылы HGPS препараттарын әзірлеу үшін қорғасын қосылыстарын анықтауға тырысады. Мамандық сыйлығы осы зерттеулерге қажетті роботтық зертханалық жабдықты сатып алу үшін пайдаланылды.
Том Мистели - тірі жасушалардағы геномдар мен ген экспрессиясын зерттеу үшін бейнелеу тәсілдерін қолданудың бастаушысы болған халықаралық танымал жасуша биологы. Ол NIH Ұлттық онкологиялық институтында аға тергеуші және директордың орынбасары. Оның зертханасының қызығушылығы – кеңістіктік геномды ұйымдастырудың іргелі принциптерін ашу және бұл білімді қатерлі ісік пен қартаюдың жаңа диагностикалық және терапиялық стратегияларын әзірлеуге қолдану. Ол Чарльз Университетінің Алтын медалін, Флемминг сыйлығын, Джан-Тондури сыйлығын, NIH директорының сыйлығын және NIH Merit Award сияқты көптеген марапаттарға ие болды. Ол көптеген ұлттық және халықаралық агенттіктерде кеңесші қызметін атқарады және бірнеше редакциялық кеңестерде қызмет етеді, соның ішінде Ұяшық. Бас редакторы Жасушалық биология журналы және Жасуша биологиясындағы қазіргі пікір.
 А типті ламиндер сүтқоректілердің жасушаларындағы ядроның маңызды құрылымдық белоктары болып табылады. Олар ядролық қабықтың ішкі бетінде орналасқан жіп тәрізді тордың негізгі құрамдас бөліктері болып табылады және ядроның пішіні мен механикалық тұрақтылығын қамтамасыз етіп қана қоймайды, сонымен қатар ДНҚ репликациясы және ген экспрессиясы сияқты маңызды жасушалық процестерге қатысады. Олардың ядролық периферияда локализациясынан басқа, ядроның ішкі бөлігінде А типті ламиндердің қосымша динамикалық пулы бар, бұл жасушалардың дұрыс пролиферациясы мен дифференциациясы үшін маңызды болып табылады. Соңғы он үш жылда А типті ламиндерді кодтайтын геннің 300-ден астам мутациялары адамның әртүрлі ауруларымен, соның ішінде Хатчинсон-Гилфорд прогерия синдромы (HGPS) ерте қартаю ауруымен байланысты болды. Молекулярлық аурудың механизмдері әлі күнге дейін нашар түсініліп, тиімді терапиялық стратегияларды әзірлеуге кедергі келтіреді. HGPS-пен байланысты А типті ламиндік гендегі мутация прогерин деп аталатын мутантты ламин А ақуызын өндіруге әкеледі. Қалыпты А ламинасынан айырмашылығы, прогерин ядроның механикалық қасиеттерін өзгертетін ядролық мембранаға тұрақты бекітіледі. Біздің жұмыс гипотеза мембраналық анкерленген прогериннің ядролық ішкі қабаттағы ламиндердің динамикалық пулына және осылайша жасуша пролиферациясына және дифференциациясына қатты әсер етеді деп болжайды.
А типті ламиндер сүтқоректілердің жасушаларындағы ядроның маңызды құрылымдық белоктары болып табылады. Олар ядролық қабықтың ішкі бетінде орналасқан жіп тәрізді тордың негізгі құрамдас бөліктері болып табылады және ядроның пішіні мен механикалық тұрақтылығын қамтамасыз етіп қана қоймайды, сонымен қатар ДНҚ репликациясы және ген экспрессиясы сияқты маңызды жасушалық процестерге қатысады. Олардың ядролық периферияда локализациясынан басқа, ядроның ішкі бөлігінде А типті ламиндердің қосымша динамикалық пулы бар, бұл жасушалардың дұрыс пролиферациясы мен дифференциациясы үшін маңызды болып табылады. Соңғы он үш жылда А типті ламиндерді кодтайтын геннің 300-ден астам мутациялары адамның әртүрлі ауруларымен, соның ішінде Хатчинсон-Гилфорд прогерия синдромы (HGPS) ерте қартаю ауруымен байланысты болды. Молекулярлық аурудың механизмдері әлі күнге дейін нашар түсініліп, тиімді терапиялық стратегияларды әзірлеуге кедергі келтіреді. HGPS-пен байланысты А типті ламиндік гендегі мутация прогерин деп аталатын мутантты ламин А ақуызын өндіруге әкеледі. Қалыпты А ламинасынан айырмашылығы, прогерин ядроның механикалық қасиеттерін өзгертетін ядролық мембранаға тұрақты бекітіледі. Біздің жұмыс гипотеза мембраналық анкерленген прогериннің ядролық ішкі қабаттағы ламиндердің динамикалық пулына және осылайша жасуша пролиферациясына және дифференциациясына қатты әсер етеді деп болжайды.
Бұл жобаның бір мақсаты - прогеринді ядролық мембранаға бекітуге жауапты механизмдерді анықтау және динамикалық ламинді бассейнді құтқару және осылайша HGPS-пен байланысты жасушалық фенотиптерді қалпына келтіру перспективасымен мембрананың бекітуін арнайы тежеу жолдарын табу. Алдыңғы нәтижелер басқа ақуыздармен кешендегі ламиннің динамикалық пулы ретинобластома ақуызы (pRb) жолы арқылы жасуша пролиферациясын реттейтінін көрсетеді. Біздің гипотезаны растау үшін жақында HGPS пациенттерінің жасушаларында pRb жолы шынымен бұзылғаны көрсетілді. Жобамыздың екінші мақсатында біз прогериннің қозғалмалы, нуклеоплазмалық ламин А бассейнінің және онымен байланысты белоктардың реттелуіне, динамикасына және белсенділігіне әсерін және оның pRb сигнализациясына молекулалық егжей-тегжейлі әсерін зерттеуді ұсынамыз. Біздің зерттеуіміздің нәтижелері HGPS артындағы ауру тудыратын молекулалық механизмдерге жарық түсіреді деп күтілуде және тиімдірек және мақсатты терапия үшін жаңа дәрілік мақсаттар мен препараттарды анықтауға көмектесуі мүмкін.
Доктор Дечат Австрия, Вена университетінде биохимия бойынша магистр және PhD дәрежесін алды. Вена медициналық университетінің жүйке-бұлшықеттік зерттеулер бөлімінде бір жыл постдок болғаннан кейін ол 2004-2009 жылдар аралығында Чикаго, Иллинойс штаты, Чикаго, Солтүстік-Батыс университеті, Проф. Роберт Голдманның зертханасында докторантураның құрылымдық және құрылымдық бөлімінде жұмыс істеді. Хатчинсон-Гилфордқа әкелетін механизмдерге басты назар аудара отырып, денсаулық пен аурудағы ядролық ламиндердің функционалдық сипаттамасы Прогериннің экспрессиясына байланысты прогерия синдромы. 2010 жылдан бастап Вена медициналық университетінің Макс Ф.Перутц зертханасының ассистенті болып табылады, жасуша циклі кезіндегі нуклеоплазмалық А типті ламиндердің және LAP2-нің құрылымдық және функционалдық қасиеттерін және А ламиналарының мутацияларымен байланысты әртүрлі ауруларды зерттейді. C және LAP2.
 Бұл зерттеуде доктор Эриксонның зертханасы сүйектегі ең көп тараған LMNA генінің мутациясының экспрессиясы бар прогерия үшін жақында әзірленген моделін пайдалануды жоспарлап отыр. Олар бұрын прогерия тері ауруы дамығаннан кейін прогерия мутациясының экспрессиясының басылуы аурудың фенотипінің толық дерлік кері кетуіне әкелетінін көрсетті (Sagelius, Rosengardtenet al. 2008). Прогерия ауруының өршу мүмкіндігін талдау үшін мутацияны тежегеннен кейін әртүрлі уақыт нүктелерінде сүйек тінінде бақыланады. Олардың алдын ала нәтижелері клиникалық симптомдардың жақсарғанын көрсетеді және осы ауруды емдеудің ықтимал әдістерін анықтауға уәде береді.
Бұл зерттеуде доктор Эриксонның зертханасы сүйектегі ең көп тараған LMNA генінің мутациясының экспрессиясы бар прогерия үшін жақында әзірленген моделін пайдалануды жоспарлап отыр. Олар бұрын прогерия тері ауруы дамығаннан кейін прогерия мутациясының экспрессиясының басылуы аурудың фенотипінің толық дерлік кері кетуіне әкелетінін көрсетті (Sagelius, Rosengardtenet al. 2008). Прогерия ауруының өршу мүмкіндігін талдау үшін мутацияны тежегеннен кейін әртүрлі уақыт нүктелерінде сүйек тінінде бақыланады. Олардың алдын ала нәтижелері клиникалық симптомдардың жақсарғанын көрсетеді және осы ауруды емдеудің ықтимал әдістерін анықтауға уәде береді.
Доктор Эриксон 1996 жылы Умеа университетінде, Швецияда молекулалық биология бойынша магистр дәрежесін және 2001 жылы Каролинска институтында неврология бойынша PhD дәрежесін алды. Ол 2001-2003 жж. PI/Ғылыми топ жетекшісі және кафедрасының доценті 2003 жылдан бастап Каролинская институтында биоғылым және тамақтану. Ол сонымен қатар Каролинская институтының медициналық генетика кафедрасының доценті. Оның ғылыми қызығушылықтары Прогерия және қартаюдың генетикалық механизмдерін қамтиды.
2011 жылғы желтоқсан (басталу күні 2012 жылдың 1 наурызы): Колин Л. Стюарт Д.Филге, Медициналық биология институты, Сингапур; «Прогериядағы тамырлардың тегіс бұлшықеттерінің нашарлауының молекулярлық негізін анықтау
Прогериямен ауыратын балалар жүрек-қан тамырлары ауруларынан, не инфаркттан, не инсульттан өледі. Соңғы онжылдықта Прогериядан зардап шеккен негізгі ұлпа баланың қан тамырлары екені белгілі болды. Прогерия қан тамырларының бұлшықет қабырғасын әлсіретіп, тегіс бұлшықет жасушаларының өлуіне әкеледі. Бұл тамырларды нәзік етіп қана қоймайды, сонымен қатар тамырдың бітелуіне әкелетін бляшкалардың пайда болуын ынталандырады. Екі нәтиже де қан тамырларының істен шығуына әкеледі және егер бұл жүрек тамырларында болса, бұл инфарктқа әкеледі.
Колин Стюарт пен оның әріптесі Оливер Дризен ядролық протеин Ламин А (прогерин) ақаулы түрі қан тамырларындағы тегіс бұлшықет жасушаларының өсуі мен тіршілігіне қалай әсер ететінін зерттеуді жоспарлап отыр. Колин мен оның әріптестері дің жасушаларының технологиясын қолдана отырып, Прогериясы бар 2 баладан алынған тері жасушаларынан дің жасушаларын ала алды. Бұл пациентке тән дің жасушалары кейіннен қан тамырларына ұқсас тегіс бұлшықет жасушаларына айналды. Бір қызығы, бұл тегіс бұлшықет жасушалары басқа жасуша түрлерімен салыстырғанда прогериннің ең жоғары деңгейлерін шығарды, бұл Прогерияның қан тамырларының неліктен ауыр зардап шегуінің ықтимал себебін көрсетеді. Прогерині бар тегіс бұлшықет жасушалары жасуша ядросындағы ДНҚ-ның зақымдалуын көрсетті. Колин мен Оливер ДНҚ-ның қандай түрі зақымдалғанын және тегіс бұлшықет жасушаларының тіршілігіне қажетті биохимиялық процестерге прогерин әсер ететінін түсіну үшін дің жасушаларынан алынған осы және басқа жасушаларды пайдаланады. Прогериясы бар балалардан жасалған тегіс бұлшықет жасушаларын тікелей зерттей отырып, олар зардап шеккен балаларды емдеуге көмектесетін жаңа препараттарды сынау үшін жаңа процедураларды әзірлеу үшін жасушаларда не дұрыс емес екенін анықтауға үміттенеді.
Колин Стюарт Оксфорд университетінде докторлық дәрежесін алды, онда ол тератокарциномалар, ES жасушаларының бастаушылары және тышқанның ерте эмбриондары арасындағы өзара әрекеттесуді зерттеді. Гамбургте Рудольф Яенишпен постдокторлық жұмыстан кейін ол Гейдельбергтегі EMBL қызметкері болды. Онда ол тінтуірдің ES жасушаларын ұстаудағы LIF цитокинінің рөлін ашуда маңызды рөл атқарды. Ол сонымен қатар ядролық ламиндерге және ядролық архитектураға қызығушылық танытты. Ол Нью-Джерсидегі Роше молекулалық биология институтына көшкеннен кейін ламиндер, дің жасушалары және геномдық импринтинг бойынша зерттеулерін жалғастырды. 1996 жылы Мэриленд штатының Фредерик қаласындағы ABL зерттеу бағдарламасына көшті және 1999 жылы Ұлттық онкологиялық институттың қатерлі ісік және даму биологиясы зертханасының меңгерушісі болып тағайындалды. Соңғы онжылдықта оның қызығушылықтары дің жасушаларындағы жасуша ядросының функционалды архитектурасына бағытталған. , регенерация, қартаю және ауру, әсіресе ядролық функциялардың қалай біріктірілгеніне қатысты дамудағы және аурудағы цитоскелеттік динамика. 2007 жылдың маусымынан бастап Сингапур биополисіндегі Медициналық биология институтының аға бас зерттеушісі және директордың көмекшісі.
Оливер Дризен қазір Сингапурдағы Медициналық биология институтының аға ғылыми қызметкері. Швейцарияның Берн қаласында бакалавриат дәрежесін бітіргеннен кейін Оливер Париждегі Пастер институтында және Сан-Диегодағы Калифорния университетінде ғылыми қызметтерді атқарды. Нью-Йорктегі Рокфеллер университетінде PhD дәрежесін алды, онда ол африкалық трипаносомалардағы антигендік вариация кезінде хромосома ұштарының (теломерлер) құрылымы мен қызметін зерттеді. Оның қазіргі ғылыми қызығушылықтары адам ауруындағы, қартаюдағы және жасушаны қайта бағдарламалаудағы теломерлердің рөліне бағытталған.
 Хатчинсон-Гилфорд прогерия синдромы (HGPS) - ламин А ақуызының мутациясынан туындаған сирек кездесетін және әлсірететін ауру. Өткен зерттеулер ауруды тудыратын А ламиніндегі мутацияларды анықтады және оның адам жасушаларында және HGPS тінтуір үлгілерінде аберрантты қызметін бағалады. Бұл ақпарат HGPS жасушаларын зардап шекпеген адамдардан алынған жасушалармен салыстыратын геномдық экспрессиялық зерттеулермен бірге бұл ауру туралы түсінуімізді айтарлықтай жақсартты. HGPS зерттеуінде назардан тыс қалған бір сала - сау бақылауларға қатысты HGPS жасушаларында болатын метаболикалық өзгерістерді мұқият талдау. Метаболикалық бұзылулар адамның көптеген ауруларымен (мысалы, атеросклероз, қант диабеті және қатерлі ісік) бірге жүреді және HGPS клиникалық бағалауы негізгі метаболикалық жолдардағы созылмалы ауытқуларды болжайды.
Хатчинсон-Гилфорд прогерия синдромы (HGPS) - ламин А ақуызының мутациясынан туындаған сирек кездесетін және әлсірететін ауру. Өткен зерттеулер ауруды тудыратын А ламиніндегі мутацияларды анықтады және оның адам жасушаларында және HGPS тінтуір үлгілерінде аберрантты қызметін бағалады. Бұл ақпарат HGPS жасушаларын зардап шекпеген адамдардан алынған жасушалармен салыстыратын геномдық экспрессиялық зерттеулермен бірге бұл ауру туралы түсінуімізді айтарлықтай жақсартты. HGPS зерттеуінде назардан тыс қалған бір сала - сау бақылауларға қатысты HGPS жасушаларында болатын метаболикалық өзгерістерді мұқият талдау. Метаболикалық бұзылулар адамның көптеген ауруларымен (мысалы, атеросклероз, қант диабеті және қатерлі ісік) бірге жүреді және HGPS клиникалық бағалауы негізгі метаболикалық жолдардағы созылмалы ауытқуларды болжайды.
Жасуша метаболиттері ақуыздармен және нуклеин қышқылдарымен бірге жасуша ішіндегі молекулалардың бүкіл репертуарын құрайтын биохимиялық заттарды білдіреді. Осылайша, метаболикалық өзгерістер аурудың патогенезіндегі ген экспрессиясының өзгеруі сияқты маңызды. Шынында да, дамып келе жатқан «метаболомика» саласы бір-бірімен байланыстыратын көптеген маңызды жаңалықтарды берді. жалғыз метаболиттер адамның спецификалық ауруларына, соның ішінде лейкозға және простата безінің метастатикалық обырына. Сондықтан HGPS-те өзгеретін метаболиттер мен метаболикалық жолдарды анықтау аурудың патогенезі туралы түсінік беруі керек және мүлдем жаңа терапиялық стратегияларды ашуы мүмкін. Бұл әсіресе HGPS-ке тән, өйткені көптеген жасушаларға негізделген және in vivo зерттеулер ламин А мутациялары қайтымсыз зақым келтірмейтінін және дұрыс өңделген жағдайда жасушалық HGPS фенотиптерін іс жүзінде жоюға болатынын көрсетті.
Дені сау донорлардан және HGPS пациенттерінен алынған жасушаларда бар метаболиттердің кешенді, салыстырмалы скринингін аяқтағаннан кейін, кейінгі биохимиялық және жасуша негізіндегі талдаулар экранда анықталған негізгі метаболиттер сау жасушаларда HGPS фенотиптерін индукциялай алатындығын немесе HGPS кері әсерін анықтайды. ауру жасушалардағы фенотиптер. Демек, бұл зерттеу HGPS-пен байланысты ламин А мутацияларының адам жасушаларындағы жаһандық метаболикалық жолдарға қалай әсер ететінін ашып қана қоймайды, сонымен қатар бұл жолдарды нысанаға алу терапиялық араласудың тиімді әдісі болып табылатынын бағалай бастайды.
Taatjes зертханасы биохимия, протеомика және криоэлектрондық микроскопия саласындағы тәжірибені біріктіріп, адам генінің экспрессиясын реттейтін іргелі механизмдерді зерттейді. Зертхана сонымен қатар механикалық нәтижелерді физиологиялық салдарлармен байланыстыруға көмектесу үшін геномдық және метаболомика әдістерін жүзеге асырады. Taatjes зертханасындағы метаболомика зерттеулері, жылдам қартаюды тудыратын p53 изоформасы бар механикалық зерттеулермен бірге осы HGPS зерттеуіне негіз болады.
 Хатчинсон-Гилфорд прогериялық синдромы (HGPS) А және С ламиндерін кодтайтын геннің мутациясынан туындайды. HGPS бар балаларда инсульт немесе миокард инфарктісіне ұшырамас бұрын шаш түсуі, сүйек ақаулары, май тіндерінің жоғалуы және басқа да жедел қартаю белгілері дамиды. олардың ерте жастық шағы. Өлгеннен кейінгі зерттеулер HGPS пациенттерінің үлкен қан тамырларындағы тамырлы тегіс бұлшықет жасушаларының күрт жоғалуын көрсетеді. Қан тамырларының тегіс бұлшықет жасушалары қан тамырларының қалыпты жұмыс істеуі үшін өте маңызды және тамырлы тегіс бұлшықет жасушаларының жоғалуы HGPS-тегі өлімге әкелетін жүрек-қан тамырлары ауруларының қозғаушы күші болуы мүмкін.
Хатчинсон-Гилфорд прогериялық синдромы (HGPS) А және С ламиндерін кодтайтын геннің мутациясынан туындайды. HGPS бар балаларда инсульт немесе миокард инфарктісіне ұшырамас бұрын шаш түсуі, сүйек ақаулары, май тіндерінің жоғалуы және басқа да жедел қартаю белгілері дамиды. олардың ерте жастық шағы. Өлгеннен кейінгі зерттеулер HGPS пациенттерінің үлкен қан тамырларындағы тамырлы тегіс бұлшықет жасушаларының күрт жоғалуын көрсетеді. Қан тамырларының тегіс бұлшықет жасушалары қан тамырларының қалыпты жұмыс істеуі үшін өте маңызды және тамырлы тегіс бұлшықет жасушаларының жоғалуы HGPS-тегі өлімге әкелетін жүрек-қан тамырлары ауруларының қозғаушы күші болуы мүмкін.
Біз бұрын HGPS пациенттерінің тері жасушалары механикалық стресске сезімтал екенін көрсеттік, бұл қайталанатын созылу кезінде жасуша өлімінің жоғарылауына әкеледі. Бұл жобада біз механикалық кернеуге сезімталдықтың жоғарылауы HGPS-тегі тамырлы тегіс бұлшықет жасушаларының үдемелі жоғалуына да жауап беретінін тексереміз, өйткені үлкен қан тамырлары жүрек соғуы сайын қайталанатын тамыр штаммына ұшырайды. Зақымдалған жасушаларды толтырудың бұзылуымен бірге механикалық сезімталдықтың жоғарылауы тамырлы тегіс бұлшықет жасушаларының үдемелі жоғалуына және HGPS-те жүрек-қан тамырлары ауруларының дамуына әкелуі мүмкін.
Механикалық кернеудің тамырлы тегіс бұлшықет жасушаларына in vivo әсерін зерттеу үшін біз қан қысымын жергілікті жоғарылату немесе ірі қан тамырларындағы тамыр жарақаттарын жасау үшін хирургиялық процедураларды қолданамыз, содан кейін қан тамырларының тегіс бұлшықет жасушаларының тірі қалуы мен регенерациясына әсерін салыстырамыз. HGPS және сау басқару элементтеріндегі тінтуір үлгісі. Осы зерттеулерден алынған түсініктер HGPS-тегі жүрек-қан тамырлары ауруларының негізінде жатқан молекулярлық механизмдер туралы жаңа ақпаратты береді және терапевтік тәсілдерді дамытуға жаңа кеңестер ұсына алады.
Доктор Ламмердинг – Корнелл университетінің биомедициналық инженерия бөлімінде және Вейл клеткалық және молекулалық биология институтында ассистент-профессор. 2011 жылы Корнелл университетіне көшкенге дейін доктор Ламмердинг Гарвард медициналық мектебі/Бригам және әйелдер ауруханасында медицина кафедрасында ассистент-профессор болып жұмыс істеді және Массачусетс технологиялық институтында оқытушы қызметін атқарды. Ламмердинг зертханасы субклеткалық биомеханиканы және механикалық стимуляцияға жасушалық сигналдық реакцияны зерттейді, әсіресе ламиндер сияқты ядролық конверт белоктарындағы мутациялар жасушаларды механикалық кернеуге неғұрлым сезімтал етіп, олардың механотрандукциялық сигналдарына қалай әсер ететініне ерекше назар аударады. Бұл жұмыстан алынған түсініктер әртүрлі ламинопатиялардың, әртүрлі аурулар тобының, соның ішінде Хатчисон-Гилфорд прогерия синдромы, Эмери-Дрейфус бұлшықет дистрофиясы және отбасылық ішінара липодистрофияның негізінде жатқан молекулалық механизмді жақсырақ түсінуге әкелуі мүмкін.
А және В типті ядролық ламиндер - жасуша ядросында орналасқан ақуыздар. Бұл белоктар ядроның ішінде бөлек, бірақ өзара әрекеттесетін құрылымдық желілерді құрайды. Ламиндер ядроның өлшемін, пішінін және механикалық қасиеттерін анықтау үшін өте маңызды; және олар хромосомаларды ұйымдастыру үшін ядроішілік тіректерді қамтамасыз етеді. Біз бір ламиндік желі мутацияның бұзылуына әкеліп соқтырған кезде, екіншісі де өзгеретінін анықтадық. Хатчинсон Гилфорд Прогерия синдромының типтік және атипті формалары ядролық ламин А генінің әртүрлі мутацияларынан туындағанымен, біз прогериялық пациенттердің жасушаларындағы В типті ламиндік желілердің де қалыптан тыс өзгеретінін анықтадық. В типті ламиндер ұрықтанудан бастап барлық соматикалық жасушаларда көрінеді және олар ДНҚ репликациясы мен ген транскрипциясын қоса алғанда, көптеген ядролық функцияларды реттеуде маңызды екені белгілі. Ламин В изоформаларына және олардың прогериядағы рөліне аз көңіл бөлінді. Бұл ұсыныста біздің мақсатымыз А ламинасының ең жиі кездесетін мутантты түрі прогерин экспрессиясының және басқа атиптік прогерия ламин А мутацияларының В типті ламиндердің экспрессиясына, құрылымына және қызметіне әсерін анықтау. Біздің алдын ала зерттеулеріміз В типті ламиндік желілердегі өзгерістер А типті ламиндермен өзара әрекеттесуіне байланысты HGPS жасушалық патологиясының маңызды медиаторлары болып табылатынын көрсетеді. Біз прогериялық пациент жасушаларындағы В типті ламиндердегі өзгерістерді және олардың жасуша өсу ақауларымен және мерзімінен бұрын қартаюмен байланысын қарастырамыз. Сондай-ақ, фарнезилтрансферазаның тежелуінің В типті ламиндердің экспрессиясына, модификациясына және тұрақтылығына әсерін зерттейтін боламыз. Бұл өте маңызды, өйткені B типті ламиндер әдетте тұрақты фарнесилденеді. Бұл ұсынылған зерттеулер прогериямен ауыратын науқастарда протеиннің фарнезиляциясын тежейтін препараттарды қолданатын тұрақты клиникалық сынақтарды ескере отырып, уақтылы жасалған. Біздің зерттеулеріміз осы ауыр аурумен ауыратын науқастарда жасушалардың ерте қартаюына жауапты молекулалық механизмдер туралы жаңа түсінік беруге уәде береді. Біздің зерттеулеріміздің нәтижелері HGPS пациенттері үшін жаңа терапияны әзірлеу кезінде ескерілетін қосымша ықтимал мақсаттар туралы түсініктерді ашуы керек.
Роберт Д. Голдман, PhD докторы, Стивен Уолтер Рэнсон профессоры және Чикагодағы Солтүстік-Батыс университетінің Фейнберг медицина мектебінің жасуша және молекулалық биология бөлімінің төрағасы. Доктор Голдман Принстон университетінде биология бойынша PhD дәрежесін алды және Лондон университетінде және Глазгодағы MRC вирусология институтында постдокторлық зерттеулер жүргізді. Ол Кейс Вестерн Резерв университетінің, Карнеги-Меллон университетінің факультеттерінде қызмет етті және Солтүстік-Батыс университетіне қосылғанға дейін Cold Spring Harbor зертханасында шақырылған ғалым болды. Ол ядро-қимыл және цитоскелеттік аралық жіп жүйелерінің құрылымы мен қызметі туралы автор ретінде кеңінен танылды. 1980-ші жылдардың басында ол ламиндердің аралық жіптердің ядролық нысаны екенін ашумен таң қалдырды. Сол уақыттан бері оның ғылыми-зерттеу зертханасы ядролық ламиндердің ядроның өлшемі мен пішінін анықтаушы және олар жасушаның бөлінуі кезінде ядроны бөлшектеу және қайта жинауда маңызды факторлар екенін көрсетті. Оның зерттеу тобы одан әрі ламиндердің ДНҚ репликациясына, транскрипциясына және хроматинді ұйымдастыруға қажетті жасуша ядросында молекулалық тірекке жиналатынын көрсетті. Соңғы жылдары оның ламиндерге деген қызығушылығы мезгілсіз қартаю ауруының Хатчинсон Гилфорд Прогерия синдромын және прогерияның басқа атипикалық түрлерін тудыратын ламин А мутациясының әсеріне бағытталған. Бұл оның хромосомаларды ұйымдастырудағы ламиндердің рөлін анықтауға, хроматиннің эпигенетикалық модификациясын реттеуге, жасуша пролиферациясы мен қартаюына әкелді.
Доктор Голдман Америка ғылымды дамыту қауымдастығының (AAAS) мүшесі болып табылады және Эллисон медициналық қорының аға ғылыми қызметкері және NIH MERIT марапаттарының иегері болды. Ол жемісті жазушы, Cold Spring Harbor Laboratory Press үшін көптеген томдарды өңдеді және FASEB журналының және жасушаның молекулалық биологиясының редакторы болып қызмет етеді. Ол ғылыми қоғамдардағы көптеген лауазымдарға сайланды, соның ішінде AAAS директорлар кеңесі, Американдық жасуша биологиясы қоғамының кеңесі және президенті және американдық анатомия, жасуша биологиясы және нейробиология кафедралары қауымдастығының президенті болды. Ол Американдық қатерлі ісік қоғамы мен NIH үшін көптеген шолу комитеттерінде қызмет етті, Теңіз биологиялық зертханасының Уитман орталығының директоры және осында және шетелде халықаралық кездесулерді ұйымдастыруға және сөйлеуге жиі шақырылады.
Хатчинсон-Гилфорд прогерия синдромы (HGPS) ламин А генінің мутациясынан туындайды, ол прогерин деп аталатын мутантты ауру ақуызының түзілуіне және жинақталуына әкеледі. Бұл ақуыз жинақталғандықтан, оның қалай ыдырайтынын анықтау емдік тұрғыдан маңызды. Бұл жұмыстың мақсаты прогерин ақуызының ыдырауына жауапты жасушалық тазарту жолдарын анықтау болып табылады. Осы ақпаратты пайдалана отырып, біз HGPS үшін қазіргі немесе болашақ терапияны жақсарту мақсатында прогерин клиренсін жеңілдету үшін осы жолдарды басқара аламыз деп үміттенеміз.
Доктор Грациотто – Массачусетс жалпы госпиталінің неврология бөлімшесінің докторантурасының қызметкері. Ол қазір доктор Димитри Крайнцтың зертханасында жұмыс істейді. Зертхананың негізгі бағыты – мутантты ақуыздар жиналып, агрегаттар түзетін нейродегенеративті бұзылыстарды зерттеу. Зертхана болашақ емдеу мақсаттарына әкелуі мүмкін осы жолдардың модификаторларын анықтау үшін осы ақуыздардың клиренс механизмдерін зерттейді.
 «Прогерия» ерте қартаюдың немесе сегменттік прогерияның әртүрлі аспектілерін көрсететін бірқатар бұзылуларды сипаттайды. Оларға LMNA мутациялары бар HGPS және MAD және ДНҚ қалпына келтіру бұзылыстары Кокайн және Вернер синдромдары кіреді. Сонымен қатар, қайталанатын, бірақ ерекше белгілері бар «атипті» прогерияның бірқатар жағдайлары бар. PRF бұрын-соңды жиналған ең үлкен когортты білдіретін атиптік прогерияның осындай 12 жағдайына жасуша желілерін және/немесе ДНҚ жинады. ДНҚ-лар LMNA экзондық мутацияларына тексерілді және ешқайсысы табылмады және олар қазір Dr.Glover зертханасында ZMPSTE мутацияларына сыналуда. Сонымен қатар, олардың классикалық Вернер және Кокайн синдромдарынан ерекшеленетін фенотиптері бар. Сондықтан бұл адамдарда бірегей прогерия гендерінде мутация бар. Мұндай жағдайлардың көпшілігі кездейсоқ болғандықтан, бұл өте қиын міндет болды. Дегенмен, соңғы бірнеше жылда ДНҚ секвенирлеу саласында орасан зор техникалық прогреске қол жеткізілді. Бүкіл геномдық экзондық секвенирлеу немесе «экзома секвенциясы» бірқатар моногенді белгілердің мутантты гендерін анықтау үшін сәтті қолданылды, соның ішінде Миллер синдромы, Кабуки синдромы, спецификалық емес ақыл-ой кемістігі, Перро синдромы және басқалар. көптеген зерттеулерді қоса алғанда прогресс жаңадан мутациялар. Бұл гендік идентификацияның қуатты құралы және алдағы бірнеше жылда біз моногендік белгілердің көпшілігінің генетикалық себебін түсінетін боламыз деп болжануда.
«Прогерия» ерте қартаюдың немесе сегменттік прогерияның әртүрлі аспектілерін көрсететін бірқатар бұзылуларды сипаттайды. Оларға LMNA мутациялары бар HGPS және MAD және ДНҚ қалпына келтіру бұзылыстары Кокайн және Вернер синдромдары кіреді. Сонымен қатар, қайталанатын, бірақ ерекше белгілері бар «атипті» прогерияның бірқатар жағдайлары бар. PRF бұрын-соңды жиналған ең үлкен когортты білдіретін атиптік прогерияның осындай 12 жағдайына жасуша желілерін және/немесе ДНҚ жинады. ДНҚ-лар LMNA экзондық мутацияларына тексерілді және ешқайсысы табылмады және олар қазір Dr.Glover зертханасында ZMPSTE мутацияларына сыналуда. Сонымен қатар, олардың классикалық Вернер және Кокайн синдромдарынан ерекшеленетін фенотиптері бар. Сондықтан бұл адамдарда бірегей прогерия гендерінде мутация бар. Мұндай жағдайлардың көпшілігі кездейсоқ болғандықтан, бұл өте қиын міндет болды. Дегенмен, соңғы бірнеше жылда ДНҚ секвенирлеу саласында орасан зор техникалық прогреске қол жеткізілді. Бүкіл геномдық экзондық секвенирлеу немесе «экзома секвенциясы» бірқатар моногенді белгілердің мутантты гендерін анықтау үшін сәтті қолданылды, соның ішінде Миллер синдромы, Кабуки синдромы, спецификалық емес ақыл-ой кемістігі, Перро синдромы және басқалар. көптеген зерттеулерді қоса алғанда прогресс жаңадан мутациялар. Бұл гендік идентификацияның қуатты құралы және алдағы бірнеше жылда біз моногендік белгілердің көпшілігінің генетикалық себебін түсінетін боламыз деп болжануда.
Осы технологиялық жетістіктерді және ұқсас пациенттердің қолжетімділігін ескере отырып, доктор Гловер атиптік прогерияға жауапты мутацияларды осы пациент үлгілерінің толық экзомалық реттілігі арқылы анықтауға болады деп болжайды. Бұл мутацияларды анықтау аурудың этиологиясын түсіну, тиімді емдеу әдістерін әзірлеу және прогериялардағы және қалыпты қартаюдағы молекулалық және жасушалық жолдармен қиылысу және өзара әрекеттесу туралы білімді дамыту үшін өте маңызды. Алайда, бұл, шамасы, барлық де жаңа мутациялар және фенотиптері гетерогенді болғандықтан, бұл қиын. Бұл зерттеудің бірден нәтижесі 7-15 жаңа, зардап шеккен отбасы мүшелері ортақ және тек отбасына ғана тән болуы мүмкін әр отбасы үшін ықтимал зиянды мутацияларды табу болады. Осы гендердің 6-12 отбасында бірлескен талдауы бір геннің әртүрлі зиянды аллельдерінің немесе бірнеше отбасында пайда болатын бір функционалдық жолдағы әртүрлі ақаулардың мысалдарын анықтауы мүмкін, осылайша жаңа кандидат гендердің/жолдардың алғашқы көрінісін қамтамасыз етеді. прогерия. Егер сәтті болса, нәтижелердің әсері үлкен болуы мүмкін және тек зардап шеккен пациентке ғана емес, сонымен қатар бір-біріне сәйкес келетін ерекшеліктерге байланысты прогерияның басқа түрлеріне, соның ішінде HGPS, сондай-ақ қалыпты қартаюға тікелей қатысты болуы мүмкін.
Доктор Гловер – Мичиган университетінің адам генетикасы және педиатрия кафедрасының профессоры. Ол 120-дан астам ғылыми жарияланымдар мен кітап тарауларының авторы. Доктор Гловер он жылдан астам уақыт бойы Progeria зерттеулеріне белсенді түрде қатысты және 2004 жылы құрылғаннан бері PRF медициналық зерттеулер комитетінің мүшесі болды. Оның зертханасы HGPS-те LMNA генінің мутациясын алғаш рет анықтаған зерттеу жұмыстарына және оны көрсетуге қатысты. фарнисляция ингибиторлары HGPS жасушаларының ядролық ауытқуларын жойып, клиникалық сынақтарға жол ашады. Оның зертханасының басты қызығушылығы адамның генетикалық ауруындағы геномдық тұрақсыздықтың механизмдері мен салдары болып табылады. Ағымдағы күш-жігер адам геномында көшірме санының варианты (CNV) мутацияларын өндіруге қатысатын молекулалық механизмдерді түсінуге бағытталған. Бұл адамның қалыпты вариациясында және көптеген генетикалық ауруларда маңызды мутацияның кең таралған, бірақ жақында ғана танылған түрі. Дегенмен, мутацияның басқа түрлерінен айырмашылығы, олардың қалай пайда болатыны және генетикалық және экологиялық қауіп факторлары толық түсінілмейді.
Бұл жобаның мақсаты Хатчинсон-Гилфорд прогерия синдромы (HGPS) жасушаларында репликация аномалиясының және геномның тұрақсыздығының молекулалық негізін анықтау болып табылады. HGPS - ерте қартаюдың басым ауруы және бұл аурумен ауыратын науқастардың орташа өмір сүру ұзақтығы небәрі 13 жыл. Ауру ламин А генінің 11-экзонындағы 1822 немесе 1824 нүктелік мутациядан туындайды, соның нәтижесінде прогерин деп аталатын 50 аминқышқылдары іштей кесілген ламин А мутантты протеин спорадикалық түзіледі. Ламин А - ядролық қабықтың және жасушалардың қаңқасының негізгі ішкі құрамдас бөлігі және прогериннің болуы HGPS жасушаларында қалыптан тыс ядролық морфологияға және геномның тұрақсыздығына әкеледі. Бір қызығы, соңғы зерттеулер прогериннің қалыпты қартайған адамдарда да өндірілетінін көрсетті және оның деңгейі жасына қарай коронарлық артерияларда жылына орта есеппен 3%-ға артады. Бұл ұлғайту HGPS және гериатриялық пациенттердегі жүрек-қан тамырлары патологиясының көптеген аспектілеріне сәйкес келеді, бұл прогериннің қартаю және қартаюмен байланысты аурулар, мысалы, қатерлі ісік және жүрек-тамыр аурулары кезінде маңызды рөлін көрсетеді.
HGPS-тің генетикалық себебі белгілі болғанымен, прогериннің әрекеті ерте қартаюмен байланысты фенотиптерге әкелетін молекулалық механизмдер әлі анық емес. Жақында біз және басқалар HGPS-тің ДНҚ қос тізбекті үзілістерінің (DSBs) жасушалық жинақталуынан туындаған геномдық тұрақсыздық фенотипіне ие екенін көрсетті. DSB жинақталуы да жүйелі қартаюдың жалпы себебі болып табылады. Соны да таптық Пигментті ксеродерма A тобы (XPA) HGPS жасушаларындағы DSB сайттарына қате локализацияланады, бұл DSB жөндеуінің тежелуіне әкеледі. HGPS жасушаларында XPA азаюы DSB жөндеуін ішінара қалпына келтіреді. Осы нәтижелерге сүйене отырып, біз HGPS-те ДНҚ зақымдануының жинақталуы қалпына келмейтін DSB түзетін, репликацияның ерте тоқтауына немесе репликативті қартаюға әкелетін репликациялық шанышқылардағы аберрантты әрекеттерге байланысты болуы мүмкін деп болжаймыз. HPGS жасушаларының репликацияның ерте тоқтауымен және ерте репликативті қартаюымен сипатталатынын ескере отырып, репликация шанышқыларындағы ақаулы әрекеттердің негізінде жатқан механизмдерді ашу HGPS фенотиптерінің себептерін түсіну үшін кілт болуы мүмкін. Түсіну ауруды тудыратын молекулалық жолдарға араласу арқылы ауруды емдеудің жаңа стратегияларына әкелуі мүмкін. Екінші жағынан, HGPS пациенттері қатерлі ісіксіз болып көрінетіні белгілі. Механизм белгісіз болғанымен, оны HPGS ерте репликативті қартаюымен байланыстыруға болады. Бұл зерттеу жобасында біз репликация шанышқыларында ДНҚ зақымдануының қалай пайда болатынын түсінуге назар аудара отырып, HGPS-те DSB жинақталуының молекулалық негізін анықтаймыз. Әрі қарай біз прогериннің ДНҚ репликация факторларымен әрекеттесетінін және өзара әрекеттесу репликация аномалиясын қалай тудыратынын анықтаймыз.
Доктор Зоу Шығыс Теннесси мемлекеттік университетінің Куиллен медицина колледжінің биохимия және молекулалық биология кафедрасының профессоры. 1991 жылы Кларк университетінде биофизика бойынша PhD дәрежесін алды. Д-р Зоудың зерттеулері негізінен қатерлі ісік ауруындағы геномның тұрақсыздығын және онымен байланысты жолдарды, соның ішінде ДНҚ жөндеу және ДНҚ зақымдануын бақылау нүктелерін түсінуге бағытталған. Ол жақында геномның тұрақсыздығы мен преламин А-ның, атап айтқанда Хатчинсон-Гилфорд Прогерия синдромының жетіспеуінен туындаған прогериядағы ДНҚ-ның зақымдану реакцияларына қызығушылық танытты және оның тобы HGPS-тегі геномның тұрақсыздығының молекулалық механизмдері туралы қызықты тұжырымдар жасады.
Доктор Каоның жұмысы Эверолимустың HGPS жасушаларына жеке немесе Ланафарнибпен біріктірілген әсерін зерттейді. Бұл зерттеу терапевтік әлеуетті де, осындай комбинаторлық терапиялық тәсілдің механикалық негізін де бағалауға мүмкіндік береді.
Доктор Као – Мэриленд университетінің жасушалық биология және молекулалық генетика кафедрасының ассистенті. Доктор Каоның зертханасы прогерия мен қалыпты қартаюдағы жасушалық механизмдерді зерттеуге қызығушылық танытады.
Доктор Макаровтың ғылыми қызығушылықтары прекурсорлық хабаршы РНҚ (мРНҚ алдындағы) сплайсинг саласында. Пре-мРНҚ сплайсинг - бұл ақуыз өндірісі үшін мРНҚ генерациялау үшін кодталмаған тізбектер (интрондар) жойылатын және кодтау реті (экзондары) біріктірілетін жасушалық процесс. mRNA-ға дейінгі сплайсинг фильмді өңдеуге біршама ұқсас: егер ол дұрыс жасалмаса, бір эпизодта сәйкес келмейтін екі көрініс біріктірілуі мүмкін, бұл мағынасы жоқ. Сплайсингте, егер экзон-интрон шекаралары (қосу орындары) дұрыс анықталмаса, қате мРНҚ түзіледі. Осыдан ақаулы ақуыз синтезделіп, ауру тудыруы мүмкін. Аналогияны кеңейту үшін фильм сценарийі көріністерді таңдау арқылы күрт өзгереді; сол сияқты, тірі жасушада пре-мРНҚ әртүрлі қосылу орындарын балама пайдалану арқылы әртүрлі тәсілдермен өңделуі мүмкін. Бұл құбылыс альтернативті сплайсинг деп аталады және бір геннен бірнеше белоктарды өндіруге мүмкіндік береді. Доктор Макаров қазіргі уақытта аурумен байланысты альтернативті сплайсингті зерттеумен айналысады. Ағымдағы негізгі жоба адамның LMNA генінің қартаюға дейінгі mRNA сплайсингін, ламин А және С протеиндерін кодтауды және әсіресе оның Хатчинсон Гилфорд Прогерия синдромы бар науқастардың ерте қартаюын тудыратын оның аберрантты сплайсингін зерттеуге арналған. Мақсат - өз кезегінде қартаю процесінің жылдамдығына әсер етуі мүмкін арнайы сплайсинг нәтижелерін модуляциялайтын ақуыздарды анықтау. Осыған байланысты, ұсынылған зерттеуде анықталған ақуыздардың фармацевтикалық мақсаттылығы - олардың әрекеттесетін шағын молекулалар арқылы функцияларын тежеу - қартаю процесін бәсеңдетуге қабілетті жаңа препараттардың ашылуына әкелуі мүмкін. Басқа іске асырылып жатқан жобалар: (i) актин-4 пре-мРНҚ-ның баламалы сплайсингімен байланысты SCLC (ұсақ жасушалы өкпе рагы) зерттеу; (ii) қатерлі ісікке қарсы әлеуетті терапиялық әдіс ретінде hTERT балама сплайсинг реттеуі.
Доктор Макаров КСРО-ның Ленинград қаласында туып-өскен, сол жерде де 1980 жылы Ленинград политехникалық университетінің биофизика факультетін бітірген. Ph.D. 1986 жылы Ленинград ядролық физика институтының молекулалық және радиациялық биофизика кафедрасынан молекулалық биология мамандығы бойынша ақуыз биосинтезінің молекулалық механизмдерін зерттеу үшін КСРО. Темір перде жойылған кезде ол шетелге шығу мүмкіндігіне ие болды және 1990-1993 жылдар аралығында АҚШ-та үш жыл жұмыс істеді (Вашингтон университеті, Сент-Луис және Дэвис университеті), онда бактерияларда РНҚ өңдеуді зерттеуді жалғастырды. 1993 жылы ол Еуропаға көшіп, Ecole Normale Supérieure, Париж, Францияда жұмыс істей бастады, онда аударма бастамасының тиімділігін зерттеді. Осы кезде ол прокариоттық трансляцияны зерттеуден бастап эукариот гендерінің экспрессиясының күрделі, жылдам дамитын салаларына тәжірибелік тәжірибесін қолдану туралы ойлана бастады. Осылайша, 1994 жылдан бастап ол өзінің ғылыми қызығушылықтарын mRNA-ға дейінгі сплайсинг саласында жүргізді. 1997 жылы доктор, Макаров РНҚ өңдеу саласындағы ең үлкен зертханалардың біріне, Германиядағы Рейнхард Люрманның зертханасына қосылудың сирек мүмкіндігіне ие болды, онда кіші ядролық рибонуклеопротеин бөлшектерін оқшаулау бойынша пионерлік жұмыстар жүргізілді. Оның жұмысы Люрманның зертханасында 2005 жылға дейін жалғасты және оның зерттеулерінің екпіні сплайцеосомаларды тазарту мен сипаттауға арналды. 2007 жылы доктор Макаров Батыс Лондондағы Брунель университетінің биоғылымдар бөліміне оқытушы болып тағайындалды, оның қазіргі зерттеулері аурумен байланысты альтернативті сплайсингке бағытталған.
Хатчинсон-Гилфорд прогерия синдромы (HGPS) ламин А генінің мутациясынан туындайды, нәтижесінде прогерин деп аталатын қысқартылған ақуыз түзіледі. Ламин А әдетте жасуша ядросының ұйымдастырылуын сақтауда маңызды қызмет атқарады және прогерин тудыратын мутация гендік реттеудегі өзгерістерге және сайып келгенде HGPS-ке әкелетін дезорганизацияға әкелуі мүмкін. Дегенмен, қандай гендер қалыпты жасушаларда ламин А-мен немесе HGPS пациенттерінің жасушаларында прогеринмен әрекеттесетіні белгісіз. Біз HGPS жасушаларында гендердің ламин А немесе прогеринмен анормальды байланысуы немесе диссоциациясы гендердің дұрыс реттелмеуіне әкеледі, нәтижесінде HGPS-ке әкеледі деп болжаймыз. Бүкіл геном бойынша қандай гендердің қалыпты А ламинімен және прогеринмен әрекеттесетінін анықтау үшін доктор Либ ChIP-seq деп аталатын әдісті орындайды. Біріншіден, ол HGPS жасушаларында ламин А немесе прогеринмен қалыптан тыс байланысатын немесе одан ажырайтын гендерді анықтауды мақсат етеді. Екіншіден, ол тінтуір үлгілеріндегі HGPS белгілерін емдеуде ішінара тиімділікті көрсететін фарнезилтрансфераза ингибиторымен (FTI) өңделген HGPS жасушаларында ChIP-seq жасайды. Бұл эксперимент тіпті FTI емдеуден кейін де қандай гендердің өзара әрекеттесулері қалыпты емес болып қалатынын анықтайды. Деректер оның командасына HGPS үшін жауапты болуы мүмкін сигналдық жолдарды және FTI-мен өңделген тінтуір үлгілерінде хабарланған тұрақты HGPS белгілерін болжауға мүмкіндік береді және HGPS пациенттері үшін жаңа препараттар мен емдеу әдістеріне түсінік береді.
Доктор Либ – биология кафедрасының және Каролина геномдық ғылымдар орталығының доценті. Оның зертханасындағы жобаларды ДНҚ қаптамасы, транскрипция факторы және ген экспрессиясы арасындағы байланыстарды түсінудің ғылыми мақсаты біріктіреді. Олар үш биологиялық жүйені пайдаланады: негізгі молекулалық механизмдерді шешу үшін S. cerevisiae (наубай ашытқысы); C. elegans қарапайым көп жасушалы организмде сол механизмдердің маңыздылығын тексеру; және (3) адамның дамуы мен ауруындағы хроматин функциясын тікелей сұрау үшін жасуша желілері мен клиникалық үлгілер. Эксперименттерді Токио университетінде аспирант ретінде оқыған доктор Кохта Икегами жүргізеді.
Доктор Мистели және оның командасы Прогерия үшін жаңа терапиялық стратегияларды әзірлеуде. Оның тобының жұмысы жоғары спецификалық молекулалық құралдарды пайдалана отырып, прогерин протеинін өндіруге кедергі келтіруге және пациент жасушаларында прогериннің зиянды әсеріне қарсы тұру үшін жаңа шағын молекулаларды табуға бағытталған. Бұл күш-жігер Progeria жасушаларын егжей-тегжейлі жасушалық биологиялық түсінуге әкеледі және бізді Progeria үшін молекулалық негізделген терапияға жақындатады.
Доктор Мистели Ұлттық онкологиялық институттың аға зерттеушісі, ол геномдардың жасушалық биологиясы тобын және NCI жасушалық скрининг бастамасын басқарады. Ол хромосома биологиясы бойынша NCI орталығының мүшесі. Доктор Мистели тірі жасушалардағы гендердің қызметін талдау технологиясының пионері болды және оның жұмысы геномдық функция туралы іргелі түсініктер берді. Доктор Мистели өз жұмысы үшін көптеген ұлттық және халықаралық марапаттарға ие болды және көптеген кеңес беру және редакциялық қызметтерді атқарады.
Тамыр функциясының төмендеуімен байланысты молекулалық механизмді түсіндіру үшін HGPS пациентінің фибробласттарынан алынған индукцияланған-плюрипотентті дің жасушалары (iPSC)
iPS жасушалары немесе индукцияланған плюрипотентті дің жасушалары - зертханада оңай алынатын және өсірілетін жетілген жасуша түрі ретінде басталған және жасушалардың генетикалық аппаратына оларды жетілмеген дің жасушаларына айналдыру үшін сигнал беретін биохимиялық «белгілермен» өңделген жасушалар. Содан кейін бұл дің жасушаларына олардың бастапқы жасуша түріне емес, қайтадан жетілуі үшін қосымша биохимиялық «белгілер» беріледі. Мысалы, тері жасушасы (жетілген) алдымен дің жасушасына (жетілмеген), содан кейін тамыр жасушасына (жетілген) айналуы мүмкін. Бұл озық технология Progeria зерттеулері үшін өте маңызды, мұнда біз зерттеу үшін адамның қан тамырларын, жүрек және сүйек жасушаларын Прогериясы бар балалардың тірі жасушаларын ала алмаймыз. PRF жасушалары мен тіндерінің банкінде оңай өсірілген Progeria тері жасушасын алу және Progeria қан тамырлары жасушасын жасау мүмкіндігі бізге Прогериядағы жүрек ауруын жаңа тәсілдермен зерттеуге мүмкіндік береді.
Бұл жасушалар іргелі зерттеулер мен дәрілік заттарды әзірлеу үшін Progeria зерттеу қоғамдастығының мүшелеріне банктік қызмет көрсету және тарату мақсатында құнды болады. Доктор Стэнфорд Прогерияда айтарлықтай азайып кеткен Progeria тамыр ауруларының дің жасушаларын (VSMC) модельдеу үшін бірнеше Progeria iPS жасушаларын жасайды.
Доктор Стэнфорд – Канаданың дің жасушаларының биоинженериясы және функционалды геномикасы бойынша ғылыми кафедрасы және Торонто университетіндегі Биоматериалдар және биомедициналық инженерия институтының доценті және директорының доценті. Ол сондай-ақ Ontario Human iPS Cell Facility компаниясының ғылыми директоры болып табылады. Оның зертханасы тіндік жасушалар биологиясы, тіндік инженерия және тінтуірдің мутагенезі мен пациентке тән iPS жасушалары арқылы адам ауруын модельдеу бойынша іргелі және қолданбалы зерттеулерге бағытталған.
Гомологиялық рекомбинация арқылы адам прогериясы индукцияланған плюрипотентті жасушаларды түзету
Доктор Толар зертханасы мезенхималық дің жасушаларымен аллогендік жасушалық терапия Progeria тінтуірінің үлгісінде өмір сүруді ұзартуға болатындығын көрсетті, бұл жасушалық терапия Прогериясы бар балаларға пайдалы болуы мүмкін екенін көрсетеді. Дегенмен, балаларда ДНҚ-ның қалыпсыз жөндеуі бар, сондықтан туыссыз донорлардан жасушаларды сіңіру үшін қажет химиотерапияның елеулі уытты әсерлері болады деп күтілуде. Сондықтан, доктор Толар мұндай уыттылықты шектейтін болады, бұл Прогерия балаларының генетикалық түзетілген жасушаларын жасап, Progeria пациенттерінің iPS жасушаларының жаңа тұжырымдамасын мырыш саусақ нуклеазалары арқылы гендік түзетудің жаңа технологиясымен біріктіреді. Осылайша, ол Прогериямен ауыратын балалар үшін түпкілікті емдеу ретінде iPS жасушаларының ұрпақты жасушалар түрлерімен қауіпсіз дің жасушалары гендік терапиясының клиникалық аудармасы үшін платформа құруды мақсат етеді.
Доктор Толар – Миннесота университетінің балалар гематологиясы-онкологиясы және балалар қаны мен кемігін трансплантациялау бөлімшелерінің ассистенті профессоры және емдеуші дәрігері. Доктор Толардың зерттеулері сүйек кемігінен алынған дің жасушалары мен гендік терапияны генетикалық ауруларды түзету және қан мен миды трансплантациялау нәтижелерін жақсартуға бағытталған.
«Мембраналарға прогериннің тартылуын сандық анықтау»
Хатчинсон-Гилфорд прогерия синдромы (HGPS) құрылымдық ядролық ламиндік протеиннің мутантты түрінің, прогериннің ядролық мембранамен анормальды байланысынан туындайды. Алайда, бұл ұлғайған бірлестіктің сипаты анықталмаған. Бұл жобада доктор Даль және оның әріптестері тазартылған ақуыздар мен тазартылған мембраналарды пайдалана отырып, қалыпты А ламині мен прогериннің мембраналық байланысындағы айырмашылықтарды сандық түрде анықтайды. Бұл жүйенің көмегімен олар ақуыз-мембраналық өзара әрекеттесу күшін нақты сандық түрде анықтай алады, мембрананың ақуызмен байланыста болатын физикалық өзгерістерін анықтай алады және интерфейстегі ақуыздың бағдарын зерттей алады. Сондай-ақ, бұл тазартылған жүйе оларға мембрана құрамы мен ерітінді заряды сияқты әртүрлі айнымалыларды басқаруға мүмкіндік береді. Тексерілетін гипотезалардың кейбірі липидтердің құйрығы мен прогеринде ұсталатын заряд шоғырының жергілікті А ламинасына қарсы рөлі және мембрананың өзара әрекеттесуіне әсері болып табылады.
 Профессор Крис Ноэль Дал – Карнеги Меллон университетінің химиялық инженерия және биомедициналық инженерия кафедраларының ассистенті. Ол Пенсильвания университетінде химия инженериясы бойынша PhD дәрежесін алды және Джонс Хопкинс медициналық мектебінің жасушалық биология бөлімінде докторлық диссертацияны өтті. Доктор Даль тобы ядроның молекулалық деңгейден көп жасушалық деңгейге дейінгі механикалық қасиеттеріне назар аударады. HGPS - мутациялар мен молекулалық қайта құрылымдау бірегей ядролық механикалық қасиеттерге әкелетін бірнеше ауру түрлерінің бірі.
Профессор Крис Ноэль Дал – Карнеги Меллон университетінің химиялық инженерия және биомедициналық инженерия кафедраларының ассистенті. Ол Пенсильвания университетінде химия инженериясы бойынша PhD дәрежесін алды және Джонс Хопкинс медициналық мектебінің жасушалық биология бөлімінде докторлық диссертацияны өтті. Доктор Даль тобы ядроның молекулалық деңгейден көп жасушалық деңгейге дейінгі механикалық қасиеттеріне назар аударады. HGPS - мутациялар мен молекулалық қайта құрылымдау бірегей ядролық механикалық қасиеттерге әкелетін бірнеше ауру түрлерінің бірі.
Хатчинсон-Гильфорд прогерия синдромындағы ядролық көлік
Ядролық қабаттың негізгі құрамдас бөлігі ретінде А ламині ядролық қабықшаның мембранасына құрылымдық пластикалық әсер етеді, хроматинді бекіту орындарын қамтамасыз етеді және мембранадағы ядролық кеуек кешендерін ұйымдастырады. Осы келісімді ескере отырып, біз Хатчинсон-Гилфорд Прогерия синдромында (HGPS) байқалған ядролық ламинадағы ақаулардың ядролық кеуек кешенінің құрылымы мен қызметіне қалай әсер ететінін зерттейміз. Бұл зерттеулер ядролық архитектурадағы өзгерістер тасымалдауға негізделген механизмдер арқылы HGPS-тегі ген экспрессиясының өзгеруіне қалай ықпал ететіні туралы түсінік беруге арналған.
Доктор Пасчал – Вирджиния университетінің Медицина мектебінің биохимия және молекулалық генетика кафедрасының доценті, ол Жасуша сигнализациясы орталығының және УКА қатерлі ісік орталығының мүшесі. Доктор Пасхал жасушаішілік тасымалдауға жауап беретін жолдарға бұрыннан қызығушылық танытады.
«Хатчинсон-Гилфорд прогерия синдромындағы эндотелий дисфункциясы және жедел атеросклероздың патобиологиясы»
Хатчинсон-Гилфорд Прогерия синдромы (HGPS) көптеген органдар жүйесіне әртүрлі жолдармен әсер етеді, бірақ оның ең ауыр көріністері жүрек-қантамыр жүйесінде болуы мүмкін, бұл атеросклероздың әдеттен тыс ауыр және жеделдетілген түріне әкеледі, бұл өлімге әкелетін инфаркттарға немесе инсульттерге әкеледі. ерте жас. Жүрек пен қан тамырлары қанға арналған Табиғаттың ыдысын құрайтын тамырлы эндотелий жасушаларынан (ЭК) тұратын мөлдір, бір жасушалы қалың қабықпен қапталған; «эндотелий дисфункциясы» деп аталатын бұл өмірлік маңызды қабаттағы патологиялық өзгерістер қазір атеросклероз сияқты тамыр ауруларының дамуы үшін маңызды деп танылады. Біздің ұсынылған зерттеулеріміздің мақсаты - HGPS жасушаларының ядроларында жиналатын мутантты прогерин протеинінің ЭК құрылымы мен қызметіне қалай әсер ететінін анықтау, бұл потенциалды эндотелий дисфункциясына әкеледі. Бұл сұрақты зерттеу үшін біз құрдық in vitro мутантты прогерин прогерин адам өсірілген ЭК-де экспрессияланатын және жоғары өнімді геномдық талдаулар мен молекулалық құрылым-функция зерттеулерінің комбинациясын пайдалана отырып, патологиялық салдарын зерттей бастаған модельдік жүйе. Біздің алдын ала деректеріміз адамның ЭК-да прогериннің жинақталуы олардың ядролық құрылымындағы елеулі өзгерістерге, ең бастысы, эндотелий дисфункциясының әртүрлі молекулалық көріністеріне әкелетінін көрсетеді. Соңғыларына атеросклероздың дамуымен байланысты екендігі дәлелденген лейкоциттердің адгезиясы молекулаларының және еритін медиаторлардың экспрессиясы жатады. Біздің зерттеулеріміз HGPS тамырлы патологиялары туралы механикалық түсінік беруге уәде береді және оны тиімді емдеудің жаңа стратегияларына әкеледі деп үміттенеміз.
Доктор Гимброн Гарвард медициналық мектебінің (HMS) патология профессоры және Бригам және әйелдер ауруханасының (BWH) патологиясының төрағасы. Ол сонымен қатар BWH қан тамырлары биологиясы бойынша шеберлік орталығының директоры. Ол Ұлттық ғылым академиясының (АҚШ), Медицина институтының және Америка өнер және ғылым академиясының сайланған мүшесі. Оның зертханасы қан тамырлары эндотелийін және оның атеросклероз сияқты жүрек-қан тамырлары ауруларындағы рөлін зерттеуге арналған. Д-р Гарсиа-Кардена – HMS патология кафедрасының ассистенті және қан тамырлары биологиясы бойынша шеберлік орталығындағы жүйелік биология зертханасының директоры. Доктор Яп Д-р Гимбронның зертханасында постдокторант болып табылады.
Ламин AD50 экспрессиясының қантамырлардан тыс жасушалық матрица өндірісіне және тамырлы аурудың дамуына әсерін анықтау үшін HGPS тінтуірінің моделін пайдалану.
Жасушадан тыс матрица (ECM) жасушаларды қоршап тұратын және құрылымдық тірек және жасушаның көршілерімен байланысу құралы ретінде әрекет ететін молекулалардан тұрады. Атеросклероздың дамуы кезінде бұл молекулалар өзгеріп, бляшканың дамуына ықпал етеді, бұл процесс көптеген адамдарда ондаған жылдарға созылады. Хатчинсон Гилфорд Прогерия синдромында (HGPS) бұл процесс күрт жеделдетілген және ЭКМ-дегі ерекше өзгерістер толық түсінілмеген. Сондықтан біз HGPS генінің атеросклеротикалық бляшкалардың дамуында маңызды рөл атқаратыны белгілі протеогликандар деп аталатын ECM молекулалар тобындағы өзгерістерге әсерін зерттеуді ұсынамыз. Мұны істеу үшін біз NIH докторы Фрэнсис Коллинздің зертханасында әзірленген HGPS тінтуірінің үлгісін зерттейміз, ол тамырлы ауруды дамытады. Осы тінтуірді пайдаланған алдыңғы зерттеулеріміз негізгі артериялардың ауру аймақтарында протеогликанға бай ECM жинақталғанын көрсетті. Майлы тағаммен қоректенетін осы тышқандардың тамырларындағы протеогликандарды зерттеумен қатар, біз Петри табақшаларында өсетін тамырлардан жасушаларды аламыз, бұл HGPS генінің қан тамырларының тегіс бұлшықеттеріне нақты әсерін мұқият зерттеуге мүмкіндік береді. ұяшық ECM. Вашингтон университетінің патология кафедрасының докторанты Ингрид Хартен осы жобада доктор Уайтпен бірге жұмыс істейді. Бұл зерттеулер HGPS-те табылған Ламин А мутантты түрі HGPS бар балаларда жедел атеросклероздың дамуына әкелетін протеогликандардың экспрессиясын реттей алатын ықтимал жолдарын анықтауға көмектеседі.
Доктор Уайт Вирджиния Мейсондағы Бенароя ғылыми-зерттеу институтының ғылыми мүшесі және 1988 жылдан 2000 жылға дейін профессор болған Вашингтон университетінде патологияның серіктес профессоры. 1972 жылы Нью-Гэмпшир университетінде PhD дәрежесін алды. Ол бұрынғы американдық жүректің зерттеушісі, NIH және AHA зерттеу бөлімдерінде қызмет еткен және қазіргі уақытта төрт ғылыми журналдың редакциялық алқасы. Доктор Уайттың зерттеу бағдарламасы дәнекер тінінің жасушалық биологиясы мен патологиясына бағытталған. Арнайы қызығушылықтарға жасуша мінез-құлқын реттеудегі, әсіресе жүрек-қан тамырлары ауруларына қатысты протеогликандар мен байланысты молекулалардың рөліне баса назар аудара отырып, жасушадан тыс матрицаның өзара әрекеттесуі кіреді.
HGPS A ламинасын кодтайтын геннің мутациясынан туындайды. Әдетте, А ламині липидті (фарнезил) және карбоксилметил тобын қосуды қоса, оның С-терминусына биохимиялық өзгерістердің өтпелі сериясынан өтеді. Сайып келгенде, модификацияланған C-терминал құйрығы А ламинасының соңғы түрін жасау үшін бөлінеді. HGPS тудыратын мутация құйрықтың бөлінуін болдырмайды, нәтижесінде А ламинасының прогерин деп аталатын тұрақты фарнесилденген және метилденген түрі пайда болады. Бірқатар зерттеулер фарнезил липидінің А ламиніне дәрілік затпен қосылуын блоктау (фарнезилтрансфераза тежегіші; FTI) прогерияның емдік стратегиясын қамтамасыз етуі мүмкін екенін көрсетеді. Бұл ұсыныста біз карбоксилметил тобының тұрақты сақталуы прогериннің уытты жасушалық әсеріне ықпал етуі мүмкін екенін зерттейміз. Олай болса, карбоксилметиалдануды тежейтін препараттарды прогерияның ықтимал емдік нұсқасы ретінде қарастыруға болады. Біз сондай-ақ прогериннің А ламинасының тұрақты фарнесилденген туысы В ламиніне еліктеу мүмкіндігін зерттейміз, осылайша ядролық мембранадағы В ламинді байланыстыратын серіктестер үшін бәсекелеседі.
Доктор Барроуман Джон Хопкинс медицина мектебінің жасушалық биология бөлімінде доктор Майклис зертханасында жұмыс істейтін постдокторлық зерттеуші. Доктор Михаэлис Джонс Хопкинс Медицина мектебінің жасушалық биология кафедрасының профессоры, фарнецирленген ақуыздарды түрлендіретін жасушалық техникаға ұзақ мерзімді қызығушылық танытады. Оның зертханасы прогериннің уытты жасушалық әсерін тежеу үшін фарнезилтрансфераза тежегіштерін (FTI) пайдаланудың ықтимал артықшылықтарын құжаттауға маңызды үлес қосты.
Ламинопатияға негізделген ерте қартаюдың дің жасушалары терапиясы
Дің жасушалары - бұл өзін-өзі жаңартып, әртүрлі жасуша түрлеріне бөлінетін жасушалар. Олар маңызды, өйткені олар денедегі тозған жасушаларды ауыстырады және біздің денеміздің функционалдық тұтастығын сақтайды. Біздің денеміздегі әртүрлі тіндер дің жасушалары арқылы тез жаңартылады және қарт адамдарда дің жасушаларының азаюы жиі кездеседі. Біз HGPS пациенттеріндегі дің жасушаларының әлеуеті бұзылған және әртүрлі тіндердің жаңаруы үшін жеткілікті жаңа жасушаларды қамтамасыз ете алмайды, сондықтан қартаю процестерін жеделдетеді деп болжаймыз. Бұл жобада доктор Чжоу HGPS тышқандарындағы дің жасушаларының саны мен функциялары төмендегенін және сау тышқандардан алынған дің жасушаларының (сүйек кемігі) HGPS тышқандарындағы қартаю фенотиптерін құтқара алатынын тексеру үшін HGPS үшін тінтуір үлгісін пайдаланады. . Ол сонымен қатар дің жасушаларының HGPS-те қалай әсер ететінін зерттейді. Бұл жұмыс ламинопатияға негізделген ерте қартаюға арналған әлеуетті терапиялық стратегияның орындылығын тікелей тексереді.
Д-р Чжоу Гонконг университетінің биохимия және медицина факультетінің доценті болып табылады және Каролинска институтында медициналық биохимия бойынша PhD дәрежесін алды, сонымен бірге институттың медициналық биохимия және биофизика бөлімінде докторантурадан кейінгі білім алды. HI тобының негізгі зерттеу бағыты ламинопатияға негізделген ерте қартаюдың молекулалық механизміне бағытталған. Испания мен Швециядағы топтармен бірлесе отырып, олар HGPS үшін тінтуір үлгісі ретінде қызмет ету үшін Zmpste24 жетіспейтін тінтуірді жасады. Олар HGPS-те табылған өңделмеген преламин А және кесілген преламин А зақымдалған ДНҚ-ға бақылау нүктесінің реакциясын/жөндеу белоктарының тартылуын бұзатынын анықтады, осылайша ақаулы ДНҚ жөндеуіне әкеледі, бұл өз кезегінде қартаюдың жеделдетілуіне ықпал етеді. Қазіргі уақытта олар дің жасушаларының HGPS-те әсер етуін зерттеп жатыр және сүйек кемігін трансплантациялау ерте қартаю фенотиптерін, кем дегенде, ішінара құтқара алатынын тышқандарда сынап жатыр.
Хатчинсон-Гилфорд Прогерия синдромы (HGPS) преламин А ақуызын кодтайтын геннің жаңа мутациясынан туындайды. Әдетте, преламин А ядродағы құрылымның ядролық қабат деп аталатын бөлігін құруға мүмкіндік беретін бірқатар биохимиялық өзгерістерге ұшырайды. HGPS-те (прогерин деп аталады) түзілген мутантты преламин А фарнезил деп аталатын липидтік топты қамтитын аралық молекуланың жинақталуына әкелетін осы биохимиялық өзгерістердің соңғысында ақаулы болып табылады. Прогериннің осы липидті нұсқасының түзілуін тежейтін FTI деп аталатын қосылыстар HGPS емдеуде емдік мақсатта қолданылады деп болжанған. Бұл ұсыныста прогериннің фарнезилді, атап айтқанда фосфатты қосқанда екінші ретті молекулалық құрылымында жаңашылдықтарды көрсетеді деген гипотезаның сынақтарын сипаттаймыз. Бұл гипотеза фосфаттың осы болжамды қосындыларына FTI әсерлері сияқты тексерілетін болады.
Доктор Синенский Шығыс Теннесси мемлекеттік университетінің Куиллен медицина колледжінің биохимия және молекулалық биология кафедрасының профессоры және кафедра меңгерушісі. 1987 және 1994 жылдар аралығында Колорадо университетінің денсаулық ғылымдары орталығында орналасқан оның зертханасы преламин А фарнесилденуі орын алғанын және молекуланың протеолитикалық жетілу жолындағы алғашқы қадам екенін көрсетті. Бұл жұмыс холестерин биосинтезінің реттелу механизмін түсінуге бағытталған күш-жігерден туындады, ол да біздің зерттеу бағдарламамыздың маңызды бөлігі болды. 1995 жылы TN-ге қоныс аударғаннан бері оның негізгі ғылыми қызығушылықтары преламин А өңдеу жолын in vitro реконструкциялау болды.
Хатчинсон-Гилфорд Прогерия синдромындағы ядролық механика мен механикалық трансдукцияның рөлі және фарнезилтрансфераза ингибиторын емдеудің әсері
Хатчинсон-Гилфорд прогерия синдромы (HGPS) ламинді A/C кодтайтын гендегі мутациялардан туындайды. Доктор Ламмердинг жуырда A/C ламині жоқ жасушалардың механикалық тұрғыдан нәзік болатынын көрсетті және механикалық ынталандыруға жауап ретінде жасушалардың өлімі жоғарылайды және қорғаныс жасушалық сигнализациясы төмендеді. Қан ағымы мен тамырлардың кеңеюіне жауап ретінде қалыптан тыс механикалық сезімталдық қан тамырларын HGPS өлімінің негізгі себебі болып табылатын атеросклерозға бейім етуі мүмкін. Сонымен қатар, механикалық кернеуге сезімталдықтың жоғарылауы HGPS пациенттерінде байқалатын сүйек және бұлшықет аномалияларына ықпал етуі мүмкін. Бұл жобада доктор Ламмердинг Хатчинсон-Гилфорд Прогерия синдромы бар науқастардың жасушаларының механикалық ынталандыру арқылы зақымдануға бейімділігін бағалау үшін бірқатар эксперименттер жүргізеді. Сонымен қатар, доктор Ламмердингтің эксперименттері фарнезил-трансфераза тежегіштерімен (FTI), HGPS үшін перспективалы жаңа препаратпен емдеу HGPS жасушаларындағы механикалық кемшіліктерді қалпына келтіре алатынын және осылайша тінге тән кейбір өзгерістердің өзгеруіне әкелетінін тексереді. аурудың фенотиптері.
Доктор Ламмердинг Гарвард медициналық мектебінің нұсқаушысы, Бригам және әйелдер ауруханасының медицина бөлімінде қызмет етеді. Оның қызығушылық аймағына субклеткалық биомеханика және механикалық ынталандыруға жасушалық сигналдық жауап кіреді. Атап айтқанда, ол ламин сияқты ядролық конверт белоктарындағы мутациялар жасушаларды механикалық кернеуге неғұрлым сезімтал етіп, олардың механикотрансдукция сигналдарына қалай әсер ететініне назар аударады. Осы жұмыстан алынған түсініктер ламинопатиялардың, оның ішінде Эмери-Дрейфус бұлшықет дистрофиясы, HGPS және отбасылық ішінара липодистрофия сияқты әртүрлі аурулар тобының негізінде жатқан молекулалық механизмді жақсырақ түсінуге әкелуі мүмкін.
2006 жылдың маусымы: Том Мистелиге, PhD, Ұлттық онкологиялық институт, NIH, Бетезда, MD
Pre-mRNA Splicing түзету арқылы HGPS үшін молекулалық терапия тәсілдері
Доктор Мистели мен оның командасы прогерияның жаңа терапиялық стратегияларын әзірлеуде. Оның тобының жұмысы жоғары спецификалық молекулалық құралдарды пайдалана отырып, прогерин ақуызының өндірісіне кедергі келтіруге және пациент жасушаларындағы прогерин ақуызының зиянды әсеріне қарсы тұру үшін жаңа шағын молекулаларды табуға бағытталған. Бұл күш-жігер прогерия жасушаларын егжей-тегжейлі жасушалық биологиялық түсінуге әкеледі және бізді прогерияның молекулалық негізделген терапиясына жақындатады.
Доктор Мистели – Ұлттық онкологиялық институттың аға зерттеушісі, ол геномдардың жасушалық биологиясы тобын басқарады. Ол хромосома биологиясы бойынша NCI орталығының мүшесі. Доктор Мистели тірі жасушалардағы гендердің қызметін талдау технологиясының пионері болды және оның жұмысы геномдық функция туралы іргелі түсініктер берді. Доктор Мистели өз жұмысы үшін көптеген ұлттық және халықаралық марапаттарға ие болды және көптеген кеңес беру және редакциялық қызметтерді атқарады.
Доктор Комаи мутантты Ламин А протеинінің прогеринінің экспрессиясы (Прогерияны тудыратын) ядродағы Ламин А құрамдас кешендердің құрамы мен қызметінің өзгеруінің салдары ретінде ерте қартаюға және жүрек ауруына әкеледі деп болжайды. Бұл гипотезаны тексеру үшін ол А ламинімен және прогеринмен дифференциалды түрде әрекеттесетін жасушалық факторларды анықтауға тырысады. Бұл зерттеулер Прогерияның молекулалық ақаулары туралы маңызды ақпарат береді, өйткені біз жасушалық деңгейде емдеу әдістерін әзірлеуге тырысамыз.
Доктор Комаи – USC Кек медицина мектебінің молекулалық микробиология және иммунология кафедрасының доценті және Кек мектебінің генетикалық медицина институтының, Норрис кешенді онкологиялық орталықтың және бауыр ауруларын зерттеу орталығының мүшесі.
2 жылдан астам уақыт бұрын Progeria генінің мутациясы ашылғаннан бері бірнеше зертханаларда Прогерияда жасалған «жаман» ламин А (прогерин) шығаратын тышқан жасау жұмыстары жүргізілді. Доктор Фонг және оның әріптестері мұны сәтті орындады, енді тінтуірдің прогеринінің жасушалардың өсуі мен метаболикалық қасиеттеріне, атеросклероздың дамуына, бүкіл жануардағы сүйек ақаулары мен липодистрофияға әсерін зерттейді және соңында олардың бар-жоғын сынамақ. аномалияларды фарнезилтрансфераза тежегіштері қалпына келтіруі мүмкін, қазіргі уақытта Прогерияны емдеуге жетекші кандидаттар.
Доктор Фонг UCLA-да адъюнкт-профессордың ассистенті болып табылады және осы маңызды ғылыми және медициналық мәселені шешу үшін 2005 жылдың мамырында PRF грантының иегері доктор Стивен Янгпен күш біріктірді.
Доктор Джабали Прогериядағы аурудың биологиялық негізін сипаттау үшін Хатчинсон Гилфорд Прогерия синдромындағы генетикалық ақаудың көптеген маңызды байланыстырушы серіктестермен тікелей байланысын көрсетуге бағытталған қызықты эксперименттер сериясын жүргізеді. Бұл жұмыс әлеуетті емдеуге әкелу үшін қажетті негізгі деректерді береді.
Д-р Джабали Колумбия университетінің медицина мектебінің дерматология кафедрасының ассистенті. Ол генетикалық байланысты аурудың молекулярлық-генетикалық зерттеулерімен және молекулалық биология, жасуша биологиясы, биохимия және протеомика салаларында айналысты.
Негізгі мутацияның ДНҚ репликациясындағы адам А ламинасының функциясына әсері
Dr. Голдман мен Шумакер Прогерия генінің мутациялары ядролық функцияны өзгертіп, Прогериясы бар балаларда ерте қартаю әсерін тудыратын молекулалық негізді анықтауға тырысады. Бұл балалардың жасына байланысты бұзылуларға жауап беретін негізгі механизмдерге, аурудың өршуімен күресу жолдарын анықтау үшін маңызды ақпаратқа жарық түсіреді.
Стивен Уолтер Рэнсон Профессор және Солтүстік-Батыс Университетінің Медицина мектебінің жасуша және молекулалық биология бөлімінің төрағасы, доктор Голдманның зерттеулері жасуша циклі кезіндегі ядролық ламиндердің динамикасына, олардың құрылымы мен қызметі арасындағы байланысты зерттеуге бағытталған. Ол Жасуша функциялары мен өзара әрекеттесуіне молекулярлық тәсілдердің NIH мүшесі және Кәмелетке толмаған қант диабеті қорының адам эмбриондық бағаналы жасушаларының консультативтік кеңесінде қызмет етеді. Ол Массачусетс штатындағы Вудс Холл теңіз биологиялық зертханасында жасуша және молекулалық биология бойынша нұсқаушы және директор болып жұмыс істеді.
Доктор Шумакер Солтүстік-Батыстағы жасуша және молекулалық биология бойынша постдокторлық ғылыми қызметкер болып табылады және 2001 жылдан бері ядролық ламиндерді зерттейтін доктор Голдманмен бірге жұмыс істейді.
Бұл зерттеу жобасының мақсаты жасушаларда мутантты преламин А (жиі «прогерин» деп аталатын) жинақталуынан туындаған Хатчинсон-Гилфорд прогерия синдромы үшін сәйкес терапияны жобалау үшін зияткерлік негіз құру үшін тінтуір үлгілерін пайдалану болып табылады. Доктор Янгтың зертханасы Прогерияның тышқан үлгісін жасайды және сол модельді Прогерияның генетикалық өзгерісі жүрек ауруына қалай әкелетінін түсіну үшін пайдаланады. Қорытындысындай БМТ шеберханасы, тінтуір үлгілерін зерттеу Прогерияны емдеу және емдеу әдістерін ашудағы маңызды келесі қадам болып табылады. Доктор Янг былай деп жазады: «Соңғы бірнеше жыл ішінде біз ламинді ауаны тазарту биологиясын зерттеу үшін жануарлардың бірнеше үлгісін жасадық... Біз осы тінтуір үлгілерін мұқият талдау HGPS терапиясының дизайнына қатысты түсініктерді беретініне толық сенімдіміз.
Доктор Янг Дж. Дэвид Гладстон институтының аға тергеушісі, UCSF медицина профессоры және Сан-Франциско жалпы ауруханасының штаттық кардиологы. Доктор Янг барлық ұсынылған зерттеулердің орындалуын басқарады және қадағалайды. Доктор Янг биомедициналық зерттеулерде генетикалық түрлендірілген тышқандарды қолдануда тәжірибелі. Оның зерттеу тобы трансгенді тышқандардың 50-ден астам желісін және гендік мақсатты 20-дан астам тышқандарды жасап, зерттеді. Соңғы жылдары доктор Янг посттрансляциялық белок модификацияларын, атап айтқанда, постизопренилизацияны өңдеу қадамдарын зерттеді. Соңғы бірнеше жылда оның зертханасы фарнезилтрансфераза, Zmpste24, Icmt және Rce1 және пренилцистеин лиазасы үшін нокаут тышқандарын шығарды.
Бұл жоба прогериннің құрылымын анықтауға (HGPS құрамындағы аномальды ақуыз), прогериннің локализациясын зерттеуге мүмкіндік беретін жасуша культурасының жүйесін әзірлеуге бағытталған; және HGPS пациенттерінің жасушалары мен тіндеріндегі прогериннің қызметі мен таралуын талдау үшін прогеринге спецификалық антиденелер мен аптамерлерді жасайды. Прогериннің құрылымын түсіну және прогериннің ауру күйін қалай тудыратынын анықтау HGPS молекулалық механизмін ашуға көмектеседі, емдеу әдістерін дамытудың ұтымды тәсілдерін жеңілдетеді.
Доктор Маллампалли Джон Хопкинс Медицина мектебінің жасуша биологиясы биофизикасы профессоры доктор Майклиспен бірге Джон Хопкинс Медицина мектебінің жасуша биологиясы бөлімінің докторлықтан кейінгі зерттеушісі.
Бұл жоба неліктен А қабатындағы мутациялар Прогерия фенотипіне әкеледі деген сұраққа жауап береді. Жақында HGPS-ке жауапты ген анықталды және HGPS синдромдар тобына қосылды - ламинопатиялар - олардың барлығы ламиндік A/C генінде (LMNA) негізгі ақауы бар. Іс жүзінде барлық HGPS пациенттері LMNA генінің 11 экзонында анормальды сплайс донорлық аймағын жасайтын бірдей мутацияға ие. Қате сплайсингтің нәтижесі С-терминусының жанында 50 аминқышқылдары жетіспейтін ақуызды жасайды. Жойылған аймақта әдетте CAAX қорапшасының фарнезиляция аймағын қоса алғанда, 18 аминқышқылын кетіретін ақуызды бөлу аймағы бар. Біздің зерттеу күш-жігеріміз қазір ауруды жақсырақ түсіну және емдеуді табудың ұзақ мерзімді мақсатына жету үшін жасуша культурасының модельдеріндегі қоздырғыш мутацияның әсерін зерттеуге бағытталған. Осы мақсатта біз мутантты ламин А экспрессиясының әртүрлі жасушалық фенотиптерге әсерін зерттейміз, соның ішінде ламин А локализациясы, жасуша өлімі, жасуша циклі және ядролық морфология. Бұл эксперименттер әртүрлі жасуша түрлеріндегі сүтқоректілердің экспрессия құрылымдарынан мутантты және қалыпты А ламинасын экспрессиялауды және HGPS жасушалық желілеріндегі табиғи ақуыздың әсерін тексеру арқылы растауды қамтиды. Сонымен қатар, біз HGPS-тегі адипогенездің in vitro моделін әзірлеп жатырмыз, ол тері астындағы майдың жетіспеушілігін және HGPS пациенттерінде байқалатын байланысты фенотиптерді түсінуге мүмкіндік береді. Соңында, біз мутантты фенотипті жасушаларға фарнесилденуді тежейтін қосылыстарға әсер ету арқылы түзетуге немесе жақсартуға болады деп болжаймыз. Біз осындай ингибиторлардың алуан түрін алдық және қазір біз бұл қосылыстардың HGPS жасушалық фенотиптеріне әсерін зерттеп жатырмыз.
Доктор Гловер Мичиган университетінің адам генетикасы кафедрасының профессоры, адамның генетикалық аурулары мен хромосомалық тұрақсыздықтың молекулярлық негіздерін зерттеумен айналысады. Ол 120-дан астам ғылыми жарияланымдар мен кітап тарауларының авторы. Оның зертханасы нәзік учаскелердегі хромосомалардың тұрақсыздығымен кеңінен жұмыс істеді және адам ауруының бірқатар гендерін анықтады және клондады, соңғы уақытта тұқым қуалайтын лимфедемаға жауапты ген және Хатчинсон-Гилфорд Прогерияға жауапты ламин А генін анықтауда бірлесіп жұмыс істеді.
Бұл жоба прогериннің дәнекер тіндеріндегі өзгерістерге, ең бастысы жүрек-қан тамырлары ауруларына әкелетін механизмді түсінуге бағытталған. HGPS бар балалар миокард инфарктісінен, тоқырау жүрек жеткіліксіздігінен және инсульттан өледі. Агрекан дәнекер тінінің құрамдас бөлігі болып табылады және HGPS пациенттерінің фибробласттарында күрт жоғарылайды. Доктор Лемир бұл агреканның шамадан тыс экспрессиясы тек фибробласттармен шектелмейді және артериялық тегіс бұлшықет жасушалары да агрекан шығарады, бұл HGPS-тегі артериялардың осы тарылуына айтарлықтай үлес қосады деп болжайды. Дұрыс екені дәлелденсе, агрекан манипуляциясы арқылы люменальды тарылудың алдын алу немесе оны жою жүрек-қан тамырлары симптомдарының басталуын кешіктіруі мүмкін.
Доктор Лемире – Тафтс университетінің ассистент-профессоры және жақында HGPS-тегі декорин рөлін зерттеуге қолдау көрсететін NIH қаржыландыратын грант алды.
HGPS үшін ықтимал емдеуді табу үшін ламин А протеинінің мутацияланған түрі прогериннің ауруға әкелетін механизмін түсіну керек. Прогеринде бар сияқты басым теріс мутация; ол жаңа функцияларды қабылдайды және жасушалық функцияларға теріс, қажетсіз әсерлер тудырады. Доктор Браун прогерин А ламині әдетте қосылмайтын негізгі ядролық протеинмен байланысады және бұл қалыпты емес байланыс зиянды әсерлер тудырады деп болжайды. Жоба мутацияның HGPS-ке қалай әкелетінін түсіндіруге көмектесу үшін осы ерекше байланыстыруды сипаттауға бағытталған.
Доктор Браун – адам генетикасы департаментінің төрағасы және Нью-Йорк штатының іргелі зерттеулер институтының Джордж А Джервис клиникасының директоры. Ол соңғы 25 жыл бойы синдромды зерттеген Прогерия бойынша әлемдік сарапшы. Оның Progeria жасушаларының бірқатар линияларының жасушалық банкингі және оның зерттеулері Прогериядағы LMNA мутацияларын анықтауға ықпал етті.
Жобаның тақырыбы: Хатчинсон-Гилфорд прогерия синдромы үшін үміткер молекулалық маркерлер
Жобаның сипаттамасы: Хатчинсон-Гилфорд прогерия синдромының (HGPS) дәл диагностикасы сенімді маркерді қажет етеді. Біз gp200-ді сипаттау үшін глиенді анықтауды қолдандық және өсірілген фибробласттардағы HGPS маркерлеріне тамаша үміткерлер болып табылатын артық экспрессиялық негізгі транскрипттерді анықтадық. Бұл бір жылдық жоба бізге gp200 анықтау үшін протеомиканы және hgpg200 жетекші транскрипцияланған кандидат маркерін зерттеу үшін нақты уақыттағы RT-ПТР әдістерін қолдануға мүмкіндік береді. Біз жарияланған gp200 талдауымыздың сезімталдығын жақсартамыз, арнайы транскрипттік талдаудың утилитасын кеңейтеміз және маркерді анықтауды жеңілдету үшін сезімтал талдау жасаймыз.
Бұл жұмыс HGPS бар балалар үшін маңызды. (1) Ол ерте және дәл диагноз қоюға көмектеседі. (2) Бұл жоба протеомика мен микромассивтердің/нақты уақыттағы RT-ПТР құралдарының комбинациясы HGPS молекулалық ерекшеліктерін зерттеу үшін алғаш рет пайдаланылғанын білдіреді. (3) Біз HGPS-ті ажырататын негізгі молекулаларды анықтаймыз. Оларды анықтау бізге HGPS молекулалық биологиясы мен биохимиясы туралы ақпарат береді. (4) 1-ші жылдың соңына қарай біз жұмсақ жағындылармен алынған шағын биопсиялық үлгілер мен тік жасушаларда ағымдағы гранттан тыс сенімді түрде қарастырылатын талдауды қамтамасыз етеміз деп күтеміз.
Өмірбаяндық эскиз: Тони Вайсс – Сидней университетінің Молекулярлық биотехнология бағдарламасының негізін қалаушы, Сидней университетінің Молекулярлық және микробтық биоғылымдар мектебінің биохимия кафедрасының доценті, Корольдік ханзада Альфредситинг Хоспиталда молекулалық және клиникалық генетика бойынша құрметті шақырылған ғалым. Ұлттық университетінде Сингапур. Тониге Рослин Флора Гулстон сыйлығы және Австралияның аспирантуралық зерттеу сыйлығы берілді, содан кейін ARC постдокторлық стипендиаты болды, содан кейін ол NIH Fogarty халықаралық стипендиаты ретінде АҚШ-қа көшті. Сидней университетінде профессорлық қызметке орналасу үшін CSIRO постдокторлық стипендиаты ретінде Австралияға оралмас бұрын ол Стэнфорд университетінде Фулбрайт стипендиясын қоса алғандағы қосымша марапаттарға ие болды. Ол екі рет Томас және Этель Мэри Юинг стипендиаты болды және LTK-да зерттеу жұмыстарын жүргізу үшін Корольдік қоғам алмасу стипендиаты болды. Тони биохимия және молекулалық биология саласына қосқан ерекше үлесі үшін Австралияның биохимия және молекулалық биология қоғамы тарапынан танылды және Amersham Pharmacia биотехнология медалімен марапатталды. Ол сонымен қатар алдыңғы екі жыл ішінде Австралияда шығарылған биология, химия, геология немесе физика бойынша ең жақсы түпнұсқалық зерттеу жұмысы үшін берілетін Дэвид Сайм атындағы зерттеу сыйлығы мен медалін алды.
Зерттеу жобасының мақсаты - мутациясы Хатчинсон-Гилфорд прогерия синдромына (HGPS) жауап беретін генді анықтау. Басқа прогероидты синдромның гені, Вернер синдромы, жақында бірнеше үлкен зардап шеккен отбасылардың генетикалық зерттеулері арқылы анықталды. Өкінішке орай, бұл тәсілді HGPS жағдайында пайдалану мүмкін емес, өйткені кеңейтілген HGPS тұқымдары бар отбасылар жоқ. Доктор Седиви мен оның әріптесі доктор Фрэнк Ротман оның орнына HGPS генін HGPS пациенттерінен алынған жасушаларды генетикалық зерттеу арқылы анықтауды ұсынды. Бұл тәсіл биотехнологиядағы соңғы екі әзірлеменің артықшылықтарын пайдаланады: біріншіден, бір уақытта көптеген гендерді зерттеуге мүмкіндік беретін жоғары тығыздықтағы cDNA немесе олигонуклеотидтік микромассивтер (әдетте «Ген чиптері» деп аталады); және екіншіден, генетикалық ақпаратты жасушадан жасушаға жоғары тиімді тасымалдауды жүзеге асыруға мүмкіндік беретін ретровирустық векторлық жүйелер. Зерттеушілер алдымен HGPS жасушаларын қалыпты жасушалардан ажырататын гендік экспрессия үлгілерін анықтауға тырысады, содан кейін HGPS жасушаларын «емдей алатын» қалыпты жасушалардағы генді (немесе гендерді) іздеу үшін ретровирус векторлық технологиясын пайдаланады.
Джон М. Седиви - Браун университетінің молекулалық биология, жасуша биологиясы және биохимиясы кафедрасының биология және медицина профессоры. 1978 жылы Торонто университетінде бакалавриат оқуын аяқтағаннан кейін 1984 жылы Гарвард университетінде микробиология және молекулалық генетика бойынша PhD дәрежесін алды. Массачусетс технологиялық институтында Нобель сыйлығының лауреаты Филипп Шарптың зертханасында соматикалық жасуша генетикасы бойынша төрт жылдық постдокторлық дайындықтан кейін ол 1988 жылы Йель университетінің факультетінде тәуелсіз ғылыми мансабын бастады. Ол 1990 жылы Президенттік жас тергеуші атанды және 1991 жылы Эндрю Меллон сыйлығын алды.
Ол 1996 жылы Браун университетіне көшті, онда ол генетикадан сабақ береді және қатерлі ісіктің негізгі биологиясы мен адам жасушалары мен тіндерінің қартаю механизмдері бойынша жұмыс істейтін зерттеу тобына жетекшілік етеді. Ол Ұлттық денсаулық институттары мен Американың қатерлі ісік қоғамы үшін көптеген сараптау комитеттерінде қызмет етті және қызмет етуді жалғастыруда. Оның зертханасын Ұлттық денсаулық сақтау институттары үнемі қаржыландырып отырады және рецензияланған журналдарда өнімді жариялау рекордын сақтады. 2000 жылы Джон Седиви қазіргі уақытта Браун университетінде құрылып жатқан Генетика және геномика орталығының директоры болып тағайындалды.
Фрэнк Г.Ротман, PhD, зерттеуші
Фрэнк Дж. Ротман – Браун университетінің биология профессоры және провости. Ол PhD дәрежесін алды. 1955 жылы Гарвард университетінің химия мамандығы бойынша дәрежесі. 1957-1961 жж. АҚШ армиясында екі жыл қызмет еткеннен кейін ол MIT-де докторантураның ғылыми қызметкері және молекулалық генетика бойынша серіктес болды. 1961 жылдан 1997 жылы зейнеткерлікке шыққанға дейін биология факультетінде болды. Браун университетінің. Ол барлық деңгейде биохимия, генетика және молекулалық биологиядан сабақ берді. Оның микроорганизмдердегі гендердің экспрессиясы жөніндегі зерттеулері 1961 жылдан 1984 жылға дейін Ұлттық ғылым қорымен үздіксіз қаржыландырылды. Ол 1984-1990 жылдары биология факультетінің деканы, 1990-1995 жылдары университет провости қызметін атқарды. 1980 жылдардың аяғында ол дөңгелек құрттың, Caenorhabditis elegans-тың қартаюына зерттеу жүргізді. Ол 1988 жылы және 1996 жылы тағы да қартаю биологиясы бойынша курстарды оқыды. Профессор ретінде ол Прогерияға назар аудара отырып, қартаю биологиясы бойынша бірлескен зерттеулермен айналысты.
«Хатчинсон-Гилфорд прогерия синдромындағы геномды қолдау»
Түпкі мақсат - HGPS үшін жауапты негізгі ақауды түсіну. Бұл жобада біз HGPS жасушаларында геномды қолдаудың нақты аспектілерін қарастырамыз. Біз үш салаға, теломера динамикасына, стихиялық мутация жылдамдығына және ДНҚ репарациясының спецификалық ерекшеліктеріне тоқталамыз. Біз HGPS фибробласттарындағы теломера деградациясының жылдамдығын теломераза экспрессиясын қатаң бақылауға мүмкіндік беретін ретровирусты білдіретін hTERT (теломераза каталитикалық суббірлігі) бар жасушаларды жұқтыру арқылы өлшейтін боламыз. Сонымен қатар, көптеген ерте қартаю синдромдары сияқты HGPS ДНҚ жөндеуінде немесе репликациясында ақау бар-жоғын анықтау үшін ДНҚ күтімі зерттеледі. Зерттеулерге HGPS фибробласттарындағы базальды p53 деңгейлерін зерттеу, HGPS фибробласттарының зақымдануға спецификалық антиденелерді пайдалана отырып, белгілі бір ДНҚ зақымдануларын жөндеу мүмкіндігін және HGPS фибробласттарындағы өздігінен болатын мутациялардың жылдамдығын зерттеу кіреді. Көптеген зерттеулерге теломеразамен өлмейтін фибробласт жасушаларының желілері кіреді, осылайша эксперименттер HGPS фибробласттарының мерзімінен бұрын қартаюынан туындаған әсерлерді өлшеусіз орындалады. Ұсынылған зерттеулер HGPS-тің негізгі ақауы геномды сақтаудың дұрыс еместігінен туындағаны туралы нақты жауаптар беруге мүмкіндігі бар. HGPS-пен байланысты жасушалық фенотиптерді анықтау ақаулы молекулалық жолдарды анықтауда және, сайып келгенде, ауру гендерін (гендерін) анықтауда құнды құрал болады.
Томас В. Гловер, Ph.D.: Доктор Гловер – Анн Арбор, Мичиган университетінің адам генетикасы және педиатрия кафедраларының профессоры. Оның зерттеу бағыты адамның генетикалық бұзылыстарының молекулярлық генетикасы және хромосомалардың тұрақсыздығы мен ДНҚ репарациясын зерттеу болып табылады. Ол адам ауруының бірқатар гендерін, соның ішінде Менкес синдромы, Эхлерс-Данлос синдромының кең таралған түрі және тұқым қуалайтын лимфедеманы анықтауға немесе клондауға қол жеткізді. Оның 100-ден астам рецензияланған ғылыми жарияланымдары бар және NIH грантының үздіксіз қолдауына ие болды. Ол бірнеше редакциялық кеңестерде қызмет етті және «Наурыз Димс» туылған ақаулар қоры мен Ұлттық денсаулық институттарының гранттық шолушысы болып табылады.
Майкл В. Глинн, MS, қосалқы зерттеуші, Ph.D дәрежесін алу үшін жоғары курс студенті. Мичиган университетінің адам генетикасы кафедрасындағы доктор Гловердің зертханасында. Ол кандидаттық біліктілікті аяқтады және барлық сыныптық жұмыстарды және оқыту талаптарын аяқтады. Құрметтерге адам генетикасы департаменті берген академиялық жетістіктері үшін Джеймс В. Нил сыйлығы кіреді. Ол бірнеше мақалалардың, кітап тарауларының және екі патенттің авторы. Майкл Коннектикут университетінде микробиология бойынша ғылым магистрі дәрежесін алды. Ол доктор Аллен Бэйлдің жетекшілігімен Йель медициналық мектебіндегі ДНҚ диагностикалық зертханасына жетекшілік етті.
«Хатчинсон-Гилфорд прогерия синдромындағы гиалурон қышқылының рөлі»
Доктор Гордон Хатчинсон-Гилфорд прогерия синдромы (HGPS) бар науқастар мен сау балалар арасындағы бір тұрақты айырмашылыққа назар аударады: HGPS пациенттерінің зәрінде белгілі бір қосылыс - гиалурон қышқылы (HA) әлдеқайда жоғары. HA өмір үшін қажет, өйткені ол тіндерді біріктіруге көмектеседі, бірақ оның тым көп болуы жаман нәрсе болуы мүмкін. Егде жастағы адамдарда HA концентрациясы жоғарылайды, ал жүрек ауруынан қайтыс болған адамдардың қан тамырларына жиналатын бляшкалар HA-ға батады. HGPS бар балалардың денесінде бірдей бляшкалар бар және бұл жүрек соғысы мен инсульттің пайда болуында маңызды рөл атқарады. HA жүрек ауруына ықпал етеді деген идея жаңа емес, бірақ бұл саладағы жұмыс жақында жаңа аналитикалық құралдармен дамыды. Зерттеудің салыстырмалы түрде зерттелмеген осы саласында доктор Гордон HA деңгейі жоғарылаған сайын аурудың асқынып бара жатқанын анықтау және бұл химиялық зат шынымен бляшканың пайда болуына ықпал ететінін анықтау үшін оның көзіне дәлелдемелерді қадағалап отыр. Егер мұндай байланыс расталса, бұл HA деңгейін төмендету арқылы Хатчинсон-Гилфорд Прогерия синдромымен де, жүрек-қан тамырлары ауруларымен де күресетін терапияға әкелуі мүмкін. Доктор Гордон: «Бұл балаларға көмектесетін кез келген емдеу жүрек-қан тамырлары аурулары және қартаюға байланысты басқа да проблемалары бар миллиондаған адамдарға көмектесуі мүмкін», - дейді.
Доктор Лесли Бет Гордон – Род-Айленд штатындағы Провиденстегі Хасбро балалар ауруханасының педиатрия бойынша нұсқаушысы және Бостондағы Тафтс университетінің медицина мектебінің ғылыми қызметкері, ол HGPS бойынша зерттеулерін жүргізеді, Массачусетс штаты. Ол 1998 жылы Браун университетінің медицина мектебінде біріктірілген MD, PhD бағдарламасын аяқтады, онда ол медициналық бағдарламада үздіктер санатына қол жеткізді және Сигма Си құрмет қоғамының мүшесі болды. . Бұған дейін ол 1991 жылы Браун университетінде ғылым магистрі дәрежесін алды. Оның Нью-Гэмпшир университетінің өнер бакалавры дәрежесі 1986 жылы берілді.
Доктор Гордон Тафтс университетінің медицина мектебінің анатомия профессоры, доктор Брайан П. Тоуленің зертханасында жұмыс істейді. Жобаға басқалар Ингрид Хартен МС, Маргарет Конрад, Р.Н. және Шарлин Драло, Р.Н.
«Артериосклероздың патофизиологиясы Хатчинсон-Гилфорд Прогерия синдромында»