Що нового в
Дослідження прогерії
Ми додали цей розділ, щоб ви могли легко отримати доступ до інформації про останні та найважливіші наукові публікації про дослідження прогерії.
На додаток до статей, виділених нижче, зараз є сотні статей про прогерію та пов’язані з прогерією теми. Ми пропонуємо вам виконати пошук у PubMed, щоб знайти конкретні теми, які ви шукаєте.
Березень 2023: захоплюючі віхи дослідження в оцінці лікування та продовженні життя!
Ми раді поділитися з вами двома захоплюючими дослідженнями, опублікованими сьогодні в найкращому світовому серцево-судинному журналі. Тираж (1):
Біомаркер у прогерії
Новий спосіб вимірювання прогерину, токсичного білка, який викликає прогерію, був розроблений командою під керівництвом співзасновника PRF і медичного директора доктора Леслі Гордона. З відкриттям цього біомаркера, який використовує плазму крові для вимірювання рівня прогерину, Дослідники можуть зрозуміти, як лікування впливає на учасників клінічних випробувань через коротший період часу і в кількох точках під час кожного клінічного випробування.
Цей тест може оптимізувати процес клінічного випробування надання ранньої інформації про ефективність тестованих методів лікування, як підведення до інших клінічних тестів, таких як збільшення ваги, дерматологічні зміни, контрактура та функція суглобів тощо, для прояву яких потрібно набагато більше часу. Ці клінічні ознаки прогерії є важливими довгостроковими показниками ефектів лікування, які тепер доповнюються рівнями прогерину, виміряними на початку терапії. Тепер ми можемо зрозуміти переваги лікування вже через чотири місяці після початку лікування або припинити лікування, яке може не принести користі учаснику дослідження, щоб уникнути непотрібних побічних ефектів.
Ще довше живе з лонафарнібом
На додаток до прискорення майбутніх відкриттів лікування та лікування, цей новий та інноваційний спосіб вимірювання прогерину вказує на те, що Довгострокова користь лонафарнібу для дітей з прогерією більша, ніж визначено раніше.
Дані дослідження вказують на те, що нижчі рівні прогерину в крові відображають переваги виживання: чим довше людина з прогерією залишався на лонафарнібі, тим більша вигода від лікування. Рівні прогерину були знижені приблизно на 30-60% протягом усього періоду прийому препарату, а очікувана тривалість життя пацієнтів, які отримували лікування понад 10 років, за оцінками, збільшилася майже на 5 років. це так більш ніж на 35% збільшення середньої тривалості життя, з 14,5 років до майже 20 років!
Щоб дізнатися більше, перегляньте наш прес-реліз тут
«Одна з найвидатніших історій, якими коли-небудь ділилися в цьому подкасті»
– Доктор Каролін Лем, всесвітньо відомий кардіолог і ведуча подкасту Циркуляція на бігу, у подорожі, яка привела до цих захоплюючих відкриттів. Послухайте повне інтерв'ю про глибокий вплив цього дослідження безпосередньо від доктора Гордона. Слухай тут (починаючи з 6:41).
Послухайте доктора Леслі Гордона про подкаст Circulation on the Run
А в червні дві редакційні статті (2) і (3) були опубліковані в Тираж підкреслюючи критичну важливість цього біомаркера для вдосконалення лікування та лікування дітей з прогерією та для кращого розуміння старіння.

(1) Гордон Л.Б., Норріс В., Хамрен С. та ін. Прогерин плазми у пацієнтів із синдромом прогерії Хатчінсона-Гілфорда: розробка імунологічного аналізу та клінічна оцінка. Тираж, 2023
(2) Прогресування серцевих аномалій при синдромі прогерії Хатчінсона-Гілфорда: проспективне лонгітюдне дослідження.
Олсен Ф. Дж., Гордон Л. Б., Смут Л., Клейнман М. Е., Герхард-Герман М., Хегде С. М., Мукундан С., Махоні Т., Массаро Дж., Ха С., Пракаш А. Тираж. 6 червня 2023 р.; 147 (23): 1782-1784. doi: 10.1161/CIRCULATIONAHA.123.064370. Epub 2023 5 червня.
(3) Легкодоступні інструменти для виявлення прогерину та прогресування серцевого захворювання при синдромі прогерії Хатчінсона-Гілфорда.
Ерікссон М., Хаугаа К., Ревечон Г. Тираж. 6 червня 2023 р.; 147 (23): 1745-1747. doi: 10.1161/CIRCULATIONAHA.123.064765. Epub 2023 5 червня.
Березень 2021: захоплюючі відкриття в РНК-терапії прогерії!
Ми раді поділитися результатами два дуже захоплюючі проривні дослідження щодо використання терапевтичних засобів РНК у дослідженні прогерії. Обидва дослідження були співфінансовані The Progeria Research Foundation (PRF) і співавтором їх був медичний директор PRF, доктор Леслі Гордон.
Прогерин є хвороботворним білком у прогерії. Терапія РНК перешкоджає здатності організму виробляти прогерин, блокуючи його виробництво на рівні РНК. Це означає, що лікування більш специфічне, ніж більшість методів лікування які націлені на прогерин на рівні білка.
Хоча в кожному дослідженні використовувалася інша система доставки ліків, обидва дослідження були спрямовані на ту саму базову стратегію лікування, пригнічуючи виробництво РНК, що кодує аномальний білок, прогерин. Обидва були опубліковані сьогодні в журналі дослідниками з Національного інституту здоров'я (NIH). Природна медицина.
Одне дослідженняпід керівництвом Френсіса Коллінза, доктора медицини, доктора філософії, директора NIH, показали, що лікування мишей Progeria препаратом під назвою SRP2001 rвикликав експресію шкідливої мРНК прогерину та білка в аорті, головна артерія в організмі, а також в інших тканинах. Наприкінці дослідження стінка аорти залишалася міцнішою, і миші продемонстрували підвищена виживаність понад 60%.
«Те, що цільова РНК-терапія показала такі значні результати на тваринній моделі, дає мені надію, що це може призвести до значного прогресу в лікуванні прогерії», — сказав Коллінз.
The інше дослідженняпід керівництвом Тома Містелі, доктора філософії, директора Центру дослідження раку Національного інституту раку Національного інституту охорони здоров’я, показали 90 – 95% зменшення токсичної РНК, що продукує прогерин в різних тканинах після лікування препаратом під назвою LB143. Лабораторія Misteli виявила, що зниження білка прогерину було найефективнішим у печінці з додатковими покращеннями в серці та аорті.
Тепер ми знаємо, що існує кілька способів зменшити вироблення шкідливого білка прогерину за допомогою РНК-терапії. Кожне дослідження виявило різні ділянки РНК у мишачих моделях, які при націлюванні забезпечували ефективний шлях лікування, що призводило до Миші, хворі на прогерію, які жили набагато довше, ніж ті, які отримували Зокінві (лонафарніб) у попередніх дослідженнях., єдиний схвалений FDA препарат для дітей з прогерією. Крім того, дослідники виявили, що комбіноване лікування РНК-терапією та Зокінві (лонафарніб) знижувало рівень білка прогерину в печінці та серці ефективніше, ніж будь-яке одне лікування окремо.
«Ці два надзвичайно важливі дослідження демонструють великі досягнення, які зараз на нас чекають у сфері цільової терапії прогерії», – сказав медичний директор PRF доктор Леслі Гордон. «Я був у захваті від співпраці з цими блискучими дослідницькими групами для просування РНК-терапії для дітей з прогерією. Обидва є захоплюючими дослідженнями на підтвердження принципів PRF з радістю просувається вперед до клінічних випробувань які застосовують ці стратегії лікування.
—
Ердос, MR, Кабрал, Вашингтон, Таварез, вул та ін. Цільовий антисмисловий терапевтичний підхід до синдрому прогерії Хатчінсона-Гілфорда. Nat Med (2021). https://doi.org/10.1038/s41591-021-01274-0
Путтараджу М., Джексон М., Кляйн С. та ін. Систематичний скринінг визначає терапевтичні антисмислові олігонуклеотиди для синдрому прогерії Хатчінсона-Гілфорда. Nat Med (2021). https://doi.org/10.1038/s41591-021-01262-4
Січень 2021: дивовижний прогрес у генетичному редагуванні моделей мишей Progeria
Науковий журнал природа опубліковані проривні результати продемонструвавши, що генетичне редагування мишачої моделі прогерії виправило мутацію, яка спричиняє прогерію в багатьох клітинах, покращило кілька ключових симптомів захворювання та різко збільшило тривалість життя мишей.
Дослідження, співфінансоване PRF і співавтором якого є медичний директор PRF д-р Леслі Гордон, виявило, що за допомогою одноразової ін’єкції базового редактора, запрограмованого на виправлення хвороботворної мутації, миші виживали в 2,5 рази довше, ніж контрольні миші без лікування Progeria, до віку, що відповідає початку старості у здорових мишей. Важливо, що миші, які отримували лікування, також зберегли здорову тканину судин — важливий висновок, оскільки втрата цілісності судин є предиктором смертності дітей із прогерією.
Дослідження проводилося під керівництвом світового експерта з генетичного редагування Девіда Лю, доктора філософії, Інституту Броуда, Массачусетський технологічний інститут, Джонатана Брауна, доцента кафедри медицини відділу серцево-судинної медицини Університету Вандербільта, і Френсіса Коллінза, доктора медичних наук, доктора філософії, Директор Національного інституту здоров'я.
«Побачити цю драматичну реакцію на нашій мишачій моделі Progeria — це одна з найцікавіших терапевтичних розробок, у яких я брав участь за 40 років як лікар-науковець», — сказав д-р Коллінз.
«П’ять років тому ми ще завершували розробку найпершого базового редактора, — сказав доктор Лю. «Якби ви тоді сказали мені, що протягом п’яти років одна доза базового редактора може впоратися з прогерією у тварини на рівні ДНК, РНК, білка, судинної патології та тривалості життя, я б сказав: «Немає жодного способу». Це справжнє свідчення відданості команди, яка зробила цю роботу можливою».
Для вивчення цих результатів необхідні додаткові доклінічні дослідження, які, як ми сподіваємося, одного разу приведуть до клінічних випробувань. Докладніше про цю захоплюючу новину читайте тут Wall Street Journal стаття.
Листопад 2020: Схвалення FDA для лонафарнібу (Зокінві)
20 листопада 2020 року PRF виконав важливу частину нашої місії: лонафарніб, перший в історії препарат для лікування прогерії, отримав схвалення FDA.
Тепер прогерія поєднує менше ніж 5% рідкісних захворювань із схваленим FDA лікуванням.* Діти та молоді люди з прогерією в США тепер можуть отримати доступ до лонафарнібу (тепер його називають «Зокінві») за рецептом, а не через клінічне випробування.
Ця знаменна віха досягнута завдяки 13 рокам наполегливих досліджень, які включали чотири клінічні випробування, усі вони координувалися PRF, що стало можливим завдяки сміливим дітям та їхнім родинам і фінансовано вами, чудовою спільнотою донорів PRF.
Натисніть тут для отримання додаткової інформації.
*300 рідкісних захворювань, лікування яких схвалено FDA (https://www.rarediseases.info.nih.gov/diseases/FDS-orphan-drugs)/7000 рідкісних захворювань, для яких відома молекулярна основа (www.OMIM. org) =4,2%
Квітень 2018: Глобальне дослідження, опубліковане в JAMA, виявило, що лікування лонафарнібом збільшує виживання дітей з прогерією
Натисніть тут для більш детальної інформації.
Асоціація лікування лонафарнібом проти відсутності лікування зі смертністю у пацієнтів із синдромом прогерії Хатчінсона-Гілфорда, Леслі Б. Гордон, доктор медичних наук, доктор філософії; Хізер Шапелл, доктор філософії; Джо Массаро, доктор філософії; Ральф Б. Д'Агостіно старший, доктор філософії; Джоан Брейзер, MS; Сьюзан Е. Кемпбелл, Массачусетс; Моніка Е. Клейнман, доктор медичних наук; Марк В. Кіран, MD, PhD; JAMA, 24 квітня 2018 року.
Липень 2016: Результати потрійного випробування
Жовтень 2014: дивовижна подорож PRF опублікована в Expert Opinion
 У статті, опублікованій в Висновок експерта і автором якого є виконавчий директор Одрі Гордон і медичний директор Леслі Гордон, два лідери PRF обговорюють історію PRF, цілі та досягнення, а також те, як програми PRF відіграли ключову роль у шляху від невідомості до лікування.
У статті, опублікованій в Висновок експерта і автором якого є виконавчий директор Одрі Гордон і медичний директор Леслі Гордон, два лідери PRF обговорюють історію PRF, цілі та досягнення, а також те, як програми PRF відіграли ключову роль у шляху від невідомості до лікування.
*"Фонд дослідження прогерії: його чудова подорож від невідомості до лікування" 30 жовтня 2014 р.
Автори пишуть: «Ми сподіваємося, що наведений нижче опис програм і послуг PRF, а також розповідь про те, як вони допомагають PRF виконувати свою місію з порятунку дітей, хворих на прогерію, допоможуть і надихнуть інших вжити подібних заходів для численні популяції рідкісних захворювань, які потребують негайної уваги».
Травень 2014: Дослідження показує, що випробувані ліки збільшують тривалість життя дітей з прогерією
Це дослідження демонструє наявність доказів того, що інгібітор фарнезилтрансферази (FTI) може продовжити життя дітей з прогерією щонайменше на півтора роки. Дослідження показало збільшення середнього виживання на 1,6 року протягом шести років після початку лікування. Два додаткових препарати, додані пізніше під час випробувань, правастатин і золедронат, також можуть сприяти цьому висновку. Це перший доказ лікування, яке впливає на виживання при цій смертельній хворобі.
Натисніть тут для більш детальної інформації.
Вплив інгібіторів фарнезиляції на виживання при синдромі прогерії Хатчінсона-Гілфорда, Леслі Б. Гордон, доктор медичних наук, доктор філософії, Джо Массаро, доктор філософії, Ральф Б. Д'Агостіно старший, доктор філософії, Сьюзен Е. Кемпбелл, Массачусетс, Джоан Брейзер, MS, В. Тед Браун, доктор медичних наук, доктор філософії, Моніка Е. Клейнман, доктор медичних наук, Марк В. Доктор медичних наук Кіран та спільна організація клінічних випробувань Progeria; Тираж, 2 травня 2014 (он-лайн).
Вересень 2012: Виявлено перше в історії лікування прогерії
Результати перше в історії клінічне випробування ліків для дітей з прогерією показують, що лонафарніб, тип інгібітора фарнезилтрансферази (FTI), спочатку розроблений для лікування раку, довів ефективність проти прогерії. Кожна дитина демонструє покращення в одному чи кількох із чотирьох способів: набирає додаткову вагу, покращує слух, покращує структуру кісток та/або, що найважливіше, підвищує гнучкість кровоносних судин. Дослідження* фінансувалося та координувалося The Progeria Research Foundation.
Натисніть тут для більш детальної інформації.
*Гордон Л.Б, Kleinman ME, Miller DT, Neuberg D, Giobbie-Hurder A, Gerhard-Herman M, Smoot L, Gordon CM, Cleveland R, Snyder BD, Fligor B, Bishop WR, Statkevich P, Regen A, Sonis A, Riley S, Ploski C, Correia A, Quinn N, Ullrich NJ, Nazarian A, Liang MG, Huh SY, Schwartzman A, Kieran MW, Клінічне випробування інгібітора фарнезилтрансферази у дітей із синдромом прогерії Хатчінсона-Гілфорда, Праці Національної академії наук, 9 жовтня 2012 вип. 109 немає 41 16666-16671
Жовтень 2011: Новий підхід до терапії прогерії
У 2005 році було показано, що аномальний сплайсинг культивованих клітин шкіри Progeria можна запобігти таким чином (2). Однак для лікування пацієнтів інгібуючий реагент повинен бути доставлений неушкодженим до всіх тканин пацієнта. знадобилося ще шість років і робота в кількох лабораторіях, щоб розробити ці методи «доставки».
У новому дослідженні (1) блокування аберрантного сплайсингу в моделі миші призвело до вражаючих результатів. Спостерігалося явне зниження концентрації прогерину в усіх проаналізованих тканинах, за винятком скелетних м’язів, які можуть мати знижене поглинання блокатора. Модель мишей повторила багато фенотипів пацієнтів з прогерією, в тому числі
- Сильно скорочена тривалість життя (103 дні порівняно з 2 роками для мишей дикого типу).
- Зниження швидкості росту.
- Ненормальна постава з викривленням хребта.
- Глибокі ядерні аберації в результаті накопичення прогерину.
- Загальна втрата жирового шару під шкірою.
- Глибокі кісткові зміни.
- Серцево-судинні зміни, включаючи значну втрату клітин гладкої мускулатури судин.
- Зміни концентрації різних гормонів у циркулюючій плазмі крові, включаючи інсулін і гормон росту.
The in vivo демонстрація ефективності зниження вироблення прогерину шляхом блокування аберантного сплайсингу є сильним кандидатом на цінний новий підхід до терапії прогерії.
(1) Osorio FG, Navarro CL, Cadiñanos J, López-Mejia IC, Quirós PM та ін., Science Translational Medicine, 3: Випуск 106, попередня он-лайн публікація, 26 жовтня (2011).
(2) Скаффіді, П. і Містелі, Т. Зміна клітинного фенотипу при передчасному старінні, синдромі прогерії Хатчінсона-Гілфорда, Nature Medicine 11 (4): 440-445 (2005).
Червень 2011: дослідження, фінансоване PRF, визначає рапаміцин як можливе лікування прогерії
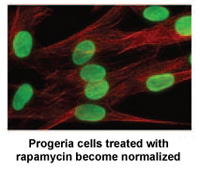
Дослідники з Національного інституту здоров’я та Массачусетської загальної лікарні в Бостоні, штат Массачусетс, опублікували нове дослідження сьогодні в Наука, трансляційна медицина що може призвести до нового медикаментозного лікування дітей з прогерією.*
Рапаміцин є схваленим FDA препаратом, який раніше показав, що подовжує життя моделям мишей без прогерії. Це нове дослідження демонструє, що рапаміцин зменшує кількість хвороботворного білка прогерину на 50%, покращує аномальну форму ядра та подовжує тривалість життя клітин прогерії. Це дослідження надає перші докази того, що рапаміцин може зменшити шкідливий вплив прогерину на дітей з прогерією.
Це величезне висвітлення в ЗМІ! Клацніть нижче, щоб отримати посилання на історії ЗМІ:
Блог про здоров'я Wall Street Journal
Дослідницький фонд Progeria був радий надати клітини для цього проекту від Банк клітин і тканин PRF, а також допомогти профінансувати дослідження через наш програма грантів.
Це захоплююче нове дослідження демонструє надзвичайні темпи дослідження прогерії, водночас надаючи додаткове розуміння процесу старіння, який впливає на всіх нас.
*"Рапаміцин змінює клітинні фенотипи та покращує кліренс мутантного білка в клітинах прогерії Хатчінсона-Гілфорда"
Кан Цао, Джон Дж. Граціотто, Сесілія Д. Блер, Джозеф Р. Мазуллі, Майкл Р. Ердос, Дімітрі Крайнк, Френсіс С. Коллінз
Sci Transl Med. 2011, 29 червня;3(89):89ra58.
Червень 2011: новаторське дослідження про зв'язок між прогерією та старінням
Вечірні новини CBS, Wall Street Journal і інші Звіт про нове дослідження
Дослідники Національного інституту здоров'я виявили раніше невідомий зв'язок між прогерією та старінням. Отримані дані дають зрозуміти зв’язок між токсичним білком, що викликає прогерію, відомим як прогерин і теломери, які захищають кінці ДНК у клітинах, доки вони з часом не зношуються, а клітини гинуть.
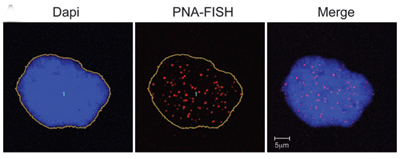
Клітини нормальних людей, що експресують прогерин, мають ознаки старіння. ДНК у ядрі забарвлюється в синій колір. Теломери видно у вигляді червоних крапок.
Дослідження* опубліковано в ранньому онлайн-виданні Journal of Clinical Investigation від 13 червня 2011 року. Він робить висновок, що при нормальному старінні короткі або нефункціональні теломери стимулюють клітини виробляти прогерин, що пов’язано з віковим пошкодженням клітин.
«Вперше ми знаємо, що вкорочення та дисфункція теломер впливає на вироблення прогерину», — каже медичний директор Фонду досліджень прогерії Леслі Б. Гордон, доктор медичних наук. Таким чином, ці два процеси, які впливають на старіння клітин, насправді пов’язані».
Попередні дослідження показали, що прогерин виробляється не тільки у дітей з прогерією, але й у менших кількостях у всіх нас, а рівень прогерину зростає з віком. Незалежно від цього, попередні дослідження вкорочення та дисфункції теломер пов’язували з нормальним старінням. З 2003 року, після відкриття мутації гена прогерії та білка прогерину, який викликає це захворювання, одним із ключових напрямків досліджень було зосереджено на розумінні того, чи пов’язані між собою прогерія та старіння і як саме.
«Зв’язок між цим рідкісним явищем захворювання та нормальним старінням приносить важливі результати», — сказав директор NIH Френсіс С. Коллінз, доктор медичних наук, старший автор статті. «Це дослідження підкреслює, що цінні біологічні знання отримані шляхом вивчення рідкісних генетичних розладів, таких як прогерія. З самого початку ми відчували, що Progeria має багато чого навчити нас про нормальний процес старіння. «
Вчені традиційно вивчали теломери і прогерин окремо. Хоча ще багато чого потрібно дізнатися про те, чи може це нове з’єднання призвести до лікування дітей, хворих на прогерію, чи потенційно може бути застосоване для продовження тривалості життя людини, це дослідження надає додаткові докази того, що прогерин, токсичний білок, виявлений шляхом виявлення мутації гена прогерії , відіграє певну роль у нормальному процесі старіння.
*Прогерин і дисфункція теломер співпрацюють, щоб викликати клітинне старіння в нормальних фібробластах людини, Цао та інші, J Clin Invest doi:10.1172/JCI43578.
Натисніть тут для повного тексту прес-релізу NIH.
Травень 2011: Виявлено причину прогероїдного синдрому, що дає додаткове розуміння зв’язку прогерії зі старінням
Дослідницька група під керівництвом дослідника Progeria Доктор Карлос Лопес-Отін з Університету Ов’єдо в Іспанії зіткнулися з двома сім’ями, діти яких мають раніше невідому хворобу прискореного старіння, схожу на прогерію. Діти не виявили жодних дефектів у генах, які раніше були пов’язані з прогероїдними захворюваннями, але, вивчаючи «кодові» частини їхніх геномів, команда виявила дефект у гені під назвою BANF1. Члени родини з прогероїдною хворобою мали дуже низьку кількість білка, виробленого BANF1, і, як і у людей з прогерією, ядерні оболонки в їхніх клітинах були помітно аномальними. Аномалії зникли в експериментах з культурою клітин, коли дефектний ген замінили правильною версією. Висновки були опубліковані в Американський журнал генетики людини у травні 2011 року.
Тепер BANF1 приєднується до групи відомих генів, які, здається, впливають на деякі форми передчасного старіння, а також можуть впливати на нормальне старіння.
За останні кілька років вчені змогли краще зрозуміти нормальне старіння на молекулярному рівні частково завдяки дослідженням синдромів передчасного старіння, подібних до цього, а також прогерії, яка «викликає ранній розвиток характеристик, зазвичай пов’язаних із літнім віком, – сказав Лопес-Отін. Він додав, що його дослідження «підкреслює важливість ядерної пластинки для старіння людини та демонструє корисність нових методів секвенування геному для виявлення генетичної причини рідкісних і руйнівних захворювань, яким традиційно приділяється обмежена увага».
Xose S. Puente, Victor Quesada, Fernando G. Osorio, Rubén Cabanillas, Juan Cadiñanos, Julia M. Fraile, Gonzalo R. Ordóñez, Diana A. Puente, Ana Gutiérrez-Fernández, Miriam Fanjul-Fernández та ін. «Секвенування екзомів і функціональний аналіз визначає мутацію BANF1 як причину спадкового прогероїдного синдрому». Американський журнал генетики людини, 5 травня 2011 р. DOI: 10.1016/j.ajhg.2011.04.010
Серпень 2010: Інсуліноподібний фактор росту 1 покращує симптоми, продовжує життя у прогероїдної миші
26 серпня 2010 р. Артеріосклероз, тромбоз і біологія судин опублікував в електронному вигляді перед друком результати дослідження, що порівнює прогерію та типове серцево-судинне старіння, під назвою «Серцево-судинна патологія при прогерії Хатчінсона-Гілфорда: кореляція з судинною патологією старіння». Дослідження показало, що прогерин, аномальний білок, який викликає прогерію, також присутній у судинній системі загальної популяції та збільшується з віком, додаючи до зростаючого випадку, що існують паралелі між нормальним старінням і старінням прогерії.
Дослідники досліджували серцево-судинні розтини та розподіл прогерину у пацієнтів з прогерією разом із групою без прогерії у віці від одного місяця до 97 років і виявили, що прогерин у осіб без прогерії збільшувався в середньому на 3,3 відсотка на рік у коронарних артеріях.
«Ми знайшли схожість між багатьма аспектами серцево-судинних захворювань як у прогерії, так і в атеросклерозі, який вражає мільйони людей у всьому світі», – сказав доктор Леслі Гордон, старший автор дослідження та медичний директор Фонду дослідження прогерії. «Досліджуючи одну з найрідкісніших хвороб у світі, ми отримуємо важливу інформацію про хворобу, яка вражає мільйони людей у всьому світі. Поточні дослідження можуть мати значний вплив на наше розуміння хвороб серця та старіння».
Це дослідження підтверджує можливість того, що прогерин є фактором ризику атеросклерозу в загальній популяції, і заслуговує на вивчення як потенційно нової ознаки, яка допоможе передбачити ризик серцевих захворювань.
Olive M, Harten I, Mitchell R, Beers J, Djabali K, Cao K, Erdos MR, Blair C, Funke B, Smoot L, Gerhard-Herman M, Machan JT, Kutys R, Virmani R, Collins FS, Wight TN, Набель Е.Г., Гордон Л.Б.
«Серцево-судинна патологія при прогерії Хатчінсона-Гілфорда: кореляція з судинною патологією старіння». Arterioscler Thromb Vasc Biol. 2010 Лист;30(11):2301-9; Epub 2010, 26 серпня.
Травень 2010: Оксфордські дослідження показують, як дослідження прогерії можуть покращити наше розуміння нормального старіння
Ця ситуація дуже схожа на ситуацію в Прогерії. Там преламін А (званий прогерином) зберігає фарнезилову групу. Дійсно, початковим кроком у спричиненні захворювання є нездатність видалити фарнезилову групу. Цей збій відбувається тому, що мутація Progeria призводить до видалення частини преламіну A, необхідної для FACE 1 для зв’язування та видалення фарнезилової групи. Таким чином, причина дефектів старіння та прогерії однакова: FACE1 не може виконувати свою роботу.
Протягом кількох років було відомо, що інгібітори фарнезилтрансферази (ІФТ) пригнічують (і можуть скасувати) наявність ядерних маркерів захворювання в клітинах прогерії. Тепер Шанахан та інші виявили, що FTI пригнічують появу подібних ядерних маркерів у клітинах нормальних людей у віці. FTI наразі використовуються в клінічних випробуваннях Progeria, і Shanahan та інші зазначають, що ці клінічні випробування «проллють додаткове світло на терапевтичний потенціал цих препаратів у лікуванні старіння».
Дослідження, описані в цій статті, є найкращим прикладом того, як дослідження прогерії сприяють нашому розумінню нормального старіння.
Ragnauth CD, Warren DT, Liu Y, Shanahan CM та інші, «Преламін А діє на прискорення старіння клітин гладкої мускулатури та є новим біомаркером старіння судин людини». Тираж: 25 травня 2010 р. С. 2200-2210.
Квітень 2010: додаткові докази того, що у прогерії присутність фарнезилової групи в молекулі прогерину відповідає за симптоми захворювання.
Девіс і його колеги підготували нову модель миші, у якої преламін А, на відміну від RD преламіну А, не є фарнезильованим, але зберігає послідовність із 15 амінокислот, яка зазвичай розщеплюється на шляху синтезу ламіну А. Ця миша не має прогероїдних симптомів, що вказує на що при RD, як і при Progeria, наявність фарнезильної групи, а не зміна послідовності амінокислот, відповідає за симптоми захворювання.
DaviesBS, Barnes RH 2nd, Tu Y, Ren S, Andres DA, Spielmann HP, Lammerding J, Wang Y, Young SG, Fong LG,
«Накопичення нефарнезильованого преламіну А викликає кардіоміопатію, але не прогерію», Hum Mol Genet. 2010, 26 квітня. [Epub перед друком]
Лютий 2010: Більше доказів того, що FTIs забезпечують сприятливий ефект завдяки фарнезилюванню прогерину
Автори оцінили ймовірність того, що полегшення прогероїдної хвороби інгібітором фарнезилтрансферази (FTI) у мишачій моделі прогерії пов’язано з ефектом препарату на фарнезилювання білка(ів), відмінного від прогерину. Вони сконструювали мишу, яка виробляла нефарнезильований прогерин, але не фарнезильований прогерин. У цієї миші також розвинулися фенотипи захворювання, подібні до прогерії, але FTI не покращив їх. Цей результат вказує на те, що препарат не діє шляхом інгібування білків, крім прогерину; він повинен впливати на фарнезилювання прогерину, біохімічний етап, який відсутній у тестованій моделі.
Ян Ш., Чанг С.Й., Андрес Д.А., Шпільман Х.П., Янг С.Г., Фонг Л.Г. «Оцінка ефективності інгібіторів білкової фарнезилтрансферази в мишачих моделях прогерії».
J Lipid Res. Лютий 2010 р.; 51 (2): 400-5. Epub 2009 26 жовт.
Жовтень 2009: мистецтво зустрічається з наукою в історії Бенджаміна Баттона
Maloney WJ, «Синдром прогерії Хатчінсона-Гілфорда: його представлення в оповіданні Ф. Скотта Фіцджеральда «Дивний випадок Бенджаміна Баттона» та його усні прояви».
Дж. Дент. рез 2009 Жовтень 88 (10): 873-6
Травень 2009 р.: Стаття відкриває новий шлях щодо впливу HGPS на функції клітин.
Раніше було показано, що HGPS впливає на багато основних клітинних функцій, включаючи реплікацію, експресію генів і відновлення ДНК. Буш і його співробітники додали до цього списку транспорт білків із цитоплазми в ядро. Усі білки синтезуються в цитоплазмі, а ті, що опиняються в ядрі, повинні потрапити через ядерну мембрану. Транспортування здійснюється через канали в ядерній мембрані, які називаються «ядерними порами». Багато білків занадто великі, щоб просто дифундувати через ядерні пори, але їх «проводять» через них спеціальні білки, які еволюціонували для цієї мети. У цій статті було виявлено, що клітини, які експресують мутантний ген, відповідальний за HGPS, мають знижений транспорт білків у ядра шляхом прямого вимірювання.
Busch A, Kiel T, Heupel WM, Wehnert M, Huebner S., «Імпорт ядерного білка знижується в клітинах, які експресують мутанти ламіну А, що викликають ядерну оболонку». Exp Cell Res. 2009 11 травня.
Квітень 2009: Зв'язок прогерії та нормального старіння: новітні ідеї
→ Забезпечення структури та організації: ядерна архітектура та цілісність геному
→ Пошкодження та відновлення ДНК пішли не так
→ Старі та неремонтні препарати, що пригнічують пухлини та клітинне старіння, а також
→ Регенерація та оновлення: біологія стовбурових клітин. Регенерація та оновлення: біологія стовбурових клітин.
Стаття висвітлює способи, за допомогою яких нещодавні досягнення у вивченні прогероїдних захворювань дають розуміння основних клітинних функцій, а також старіння.
Capell BS, Tlougan BE, Orlow SJ, «Від найрідкісніших до найпоширеніших: розуміння прогероїдних синдромів у раку шкіри та старінні». Журнал слідчої дерматології (23 квітня 2009), 1-11
Квітень 2009: минулі грантоотримувачі PRF Research розробили новий метод дослідження прогерину в клітинах
Попередні експерименти з клітинами фібробластів пацієнтів з прогерією показали, що пошкодження, спричинене мутацією, спочатку є результатом дії зміненої форми ламіну А, яка називається прогерином. Але інтерпретація цих експериментів може бути складною в культурі для різної кількості поколінь. Фонг та ін. ал. створили експериментальну систему, в якій кількість прогерину в Дикого типу кількість клітин може бути збільшена або зменшена. Цей метод дозволить дослідникам відокремити прямі ефекти прогерину від вторинних, тим самим просунувши дослідження клітинних механізмів, які призводять до патофізіології клітин прогерії.
Активація синтезу прогерину, мутантного преламіну А при синдромі прогерії Хатчінсона-Гілфорда, з антисмисловими олігонуклеотидами. (Стаття PubMed) Fong LG, Vickers TA, Farber EA, Choi C, Yun UJ, Hu Y, Yang SH, Coffinier C, Lee R, Yin L, Davies BS, Andres DA, Spielmann HP, Bennett CF, Young SG, «Активація синтезу прогерин, мутантний преламін А при синдромі прогерії Хатчінсона-Гілфорда, з антисмисловим олігонуклеотиди». Hum Mol Genet. 2009 17 квітня.
доктора Фонг і Янг раніше отримували гранти від The Progeria Research Foundation.
Січень 2009: Кількісне визначення експресії гена прогерії в нормальних і прогерійних клітинах за допомогою нової, потужної техніки.
Шведська команда виявила накопичення РНК прогерину в нормальних клітинах у міру їх старіння
Прогерин є аномальним білком, що викликає прогерію. В останні роки кілька дослідницьких груп виявили, що нормальні клітини також виробляють прогерин, але набагато менше, ніж клітини дитини з прогерією. Крім того, кількість білка прогерину в нормальних клітинах збільшується в міру старіння в лабораторії. Ці результати встановили прямий зв'язок на клітинному рівні між прогерією та нормальним старінням.
Доктор Марія Ерікссон, автор відкриття гена прогерії в 2003 році, тепер винайшла нову потужну техніку для кількісного вимірювання експресії гена прогерії. Лабораторія доктора Ерікссона в Каролінському інституті в Швеції використовувала цю техніку для вимірювання кількості РНК прогерину як у нормальних клітинах, так і в клітинах Progeria. РНК є структурною молекулою в наших клітинах для виробництва білка. Шведська група виявила, що як нормальні клітини, так і клітини прогерії у міру старіння виробляють все більшу кількість РНК прогерину. Результати Ерікссона показують, що РНК-сигнал для створення прогерину швидко формується в клітинах дітей з прогерією та повільно формується протягом життя в усіх нас.
Ці нові відкриття зміцнюють наше розуміння зв'язку між нормальним старінням і прогерією. Крім того, очікується, що нова методика буде широко використовуватися в експериментах, які стосуються механізму дії прогерину.
Rodriguez S, Coppedè F, Sagelius H та Erikson M. «Підвищена експресія скороченого транскрипту ламіну А прогерії синдрому Хатчінсона-Гілфорда під час старіння клітин». Європейський журнал генетики людини (2009), 1-10.
Серпень і жовтень 2008: чи прогерія оборотна? Дві останні публікації показують, що FTI та генна терапія можуть зробити саме це!
Два окремих дослідження показують, що прогерія оборотна в серцево-судинній системі та шкірі мишачих моделей. Експерименти були значущими в тому, що мишей не лікували до тих пір, поки вони не виявляли симптомів прогерії, тоді як більшість попередніх досліджень починали лікування до появи прогерії. Виробництво прогерину (пошкоджувального білка, що утворюється з гена Progeria) пригнічувалося або лікуванням інгібітором фарнезилтрансферази (FTI), або вимкненням гена. В обох випадках миші повернулися до нормальних або майже нормальних умов. Ці спостереження надають обнадійливі докази для поточного клінічного випробування FTI проти прогерії.
У приголомшливому прояві прогресу з препаратом FTI, який зараз використовується в Перше в історії клінічне випробування препарату прогерії – Дослідницька група доктора Френсіса Коллінза з Національного інституту охорони здоров’я* виявила, що FTI запобігає та навіть усуває найбільш руйнівний ефект прогерії у мишей: серцево-судинні захворювання.* «Ми були вражені, що [препарат] так добре спрацював», — говорить Френсіс Коллінз, генетик і колишній директор Національного науково-дослідного інституту геному людини, який був старшим автором дослідницької групи, яка виявила мутацію гена Progeria у 2003. «Цей препарат не тільки запобіг розвитку серцево-судинних захворювань у цих мишей, він усунув пошкодження у мишей, які вже хворіли».
У мишей, хворих на прогерію, розвивається хвороба серця, подібна до хвороби дітей, хворих на прогерію. Автори виявили, що FTI зміг певною мірою запобігти розвитку серцевих захворювань, коли мишей отримували лікування з моменту відлучення від грудей, і частково повернути назад встановлене захворювання, коли мишей лікували, починаючи з 9-місячного віку. «Однією з вражаючих речей, з моєї точки зору, була здатність повернути хворобу назад», — сказав Коллінз, що є критично важливим, враховуючи, що прогерію зазвичай не діагностують при народженні, а лише тоді, коли у дітей починають проявлятися симптоми, коли частина пошкодження вже зникла. зроблено.
«Якщо буде виявлено, що ці ліки мають подібну дію на дітей, це може означати великий прорив у лікуванні цієї руйнівної хвороби», — сказав доктор Набель з NHLBI, який був співавтором дослідження. «Крім того, ці результати проливають світло на потенційну роль препаратів FTI для лікування інших форм ішемічної хвороби серця».
Переглянути статтю в Scientific American, «Нова надія на прогерію: ліки від рідкісних захворювань старіння», на https://www.sciam.com/article.cfm?id=new-hope-for-progeria-drug-for-rare-aging-disease і прес-реліз NIH на https://www.nih.gov/news/health/oct2008/nhgri-06.htm
* Капелл та ін. Аль, «Інгібітор фарнезилтрансферази запобігає як появі, так і пізньому прогресуванню серцево-судинних захворювань у мишачої моделі Progeria». Праці Національної академії наук, том. 105, вип. 41, 15902-15907 (14 жовтня 2008 р.)
У другому дослідженні, опублікованому в Інтернеті в Journal of Medical Genetics**, дослідницька група доктора Марії Ерікссон з Каролінського інституту в Швеції створила іншу мишачу модель прогерії з аномаліями шкіри та зубів. Миші створені за допомогою генної інженерії, щоб мутацію Progeria можна було вимкнути в будь-який момент. Як тільки хвороба стала очевидною, ген прогерії був вимкнений. Через 13 тижнів шкіра майже не відрізнялася від нормальної шкіри. Це дослідження показує, що в цих тканинах експресія мутації прогерії не спричиняє незворотних пошкоджень і що можливе зворотне перебіг хвороби, що є перспективою лікування прогерії.
**Ерікссон та ін. ін., «Оборотний фенотип у мишачої моделі синдрому прогерії Хатчінсона-Гілфорда». J. Med. Жене. опубліковано онлайн 15 серпня 2008 р.; doi:10.1136/jmg.2008.060772
Щоб придбати цю статтю, перейдіть за адресою: https://jmg.bmj.com/cgi/rapidpdf/jmg.2008.060772v1
Більше доказів зв'язку між прогерією та нормальним старінням і серцевими захворюваннями
Ці захоплюючі дослідження Capell та Eriksson показують, що окрім прогерії, ці результати можуть принести користь усім пацієнтам із серцево-судинними захворюваннями. Дослідники виявили, що токсичний білок, відповідальний за прогерію, насправді виробляється в низьких кількостях у всіх людей і, можливо, накопичується з віком. Таким чином, вивчаючи цих рідкісних дітей, ми можемо розширити наше розуміння основного механізму старіння людини — і, можливо, знайти нові способи уповільнити цей процес.

